ژندرمانی بیماریهای ریوی با نانوذرات پلیمری
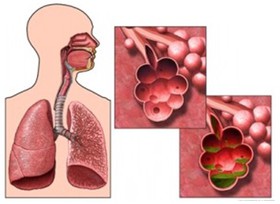 محققان با استفاده از نانوذرات زیستتخریب پذیر موفق به ارائه روش درمانی جدیدی برای ژندرمانی شدند که امکان درمان بیماریهای ژنتیکی ریوی را فراهم میکند. اخیرا مقالهای توسط محققان دانشگاه جانهاپکینز با عنوان Highly compacted biodegradable DNA nanoparticles capable of overcoming the mucus barrier for inhaled lung gene therapy در نشریه Proceedings of the National Academy of Sciences (PNAS) منتشر شده که در آن از نانوساختارهای DNA برای درمان بیماریهای ریه استفاده شده است.
محققان با استفاده از نانوذرات زیستتخریب پذیر موفق به ارائه روش درمانی جدیدی برای ژندرمانی شدند که امکان درمان بیماریهای ژنتیکی ریوی را فراهم میکند. اخیرا مقالهای توسط محققان دانشگاه جانهاپکینز با عنوان Highly compacted biodegradable DNA nanoparticles capable of overcoming the mucus barrier for inhaled lung gene therapy در نشریه Proceedings of the National Academy of Sciences (PNAS) منتشر شده که در آن از نانوساختارهای DNA برای درمان بیماریهای ریه استفاده شده است.
نانوذرات ابزار مناسبی برای ژندرمانی هستند به طوری که میتوان ناهنجاریهای مختلف را با استفاده از این نانوذرات رفع کرد. برای درمان مشکلات ریوی، استفاده از نانوذرات چالشبرانگیز است زیرا سد زیستی در مسیر رهاسازی ژندرمانی وجود دارد. وجود لایهای مخاطی در سراسر سیستم تنفسی عامل محافظت از اندامهای تنفسی در برابر عفونت و عوامل میکروبی خارجی است. همین سیستم مخاط مانع اثربخشی روشهای درمان تنفسی شده و اجازه ورود دارو به این سیستم را نمیدهد.
پژوهشگران از نانوذرات حاوی DNA برای غلبه بر این سد استفاده کردند. آنها از نانوذرات پلیمری زیستسازگار موسوم به PBAEs که دارای روکشی از جنس پلیاتیلن گلیکول است استفاده کردند. این نانوذرات توانستند درون مخاط موجود در سیستم تنفسی نفوذ کنند. این گروه تحقیقاتی این نانوذرات را روی موشهای آزمایشگاهی استفاده کردند و دریافتند بیان ژن در مقادیر بسیار بالایی در این حیوانات انجام شد. نتایج آزمایشها نشان میدهد که این نانوذرات هیچ اثر سمی روی بدن نداشته و به دلیل زیستتخریبپذیر بودن آن کاملاً از بدن دفع شده و درون بدن جمع نمیشوند.
این یافتههای جدید اهمیت زیادی برای درمان بیماری سیستیک فیبروسیس دارد. این بیماری نوعی بیماری ژنتیکی خطرناک است که در آن مخاط بیماری بسیار ضخیم و چسبنده است که مشکلات تنفسی جدی به همراه دارد.
این گروه تحقیقاتی نشان دادند که رهاسازی ژن نرمال با استفاده از نانوذرات حاوی DNA میتواند پروتئینهای ویژهای را در بیمار ایجاد کند که به مدت طولانی در بدن بیمار باقی میماند. محققان معتقدند که این روش میتواند برای درمان بیماریهای مختلفی در انسان به کار رود. برای مثال، این روش برای درمان بیماریهای ژنتیکی ریوی که بسیار خطرناک هستند مناسب است.
 محققان آمریکایی با تزریق دستهای از نانوذرات خاص به مغز موشها، موفق شدهاند نوعی ارتباط مستقیم و بیسیم با نورونهای شبکه عصبی برقرار کنند. اعمال یک میدان مغناطیسی خارجی، سبب تولید یک میدان الکتریکی موضعی توسط این نانوذرات میشود که قادر است مستقیماً با میدان الکتریکی مغز ارتباط برقرار کند. از این روش برای انتقال دارو به مغز نیز میتوان استفاده کرد.
محققان آمریکایی با تزریق دستهای از نانوذرات خاص به مغز موشها، موفق شدهاند نوعی ارتباط مستقیم و بیسیم با نورونهای شبکه عصبی برقرار کنند. اعمال یک میدان مغناطیسی خارجی، سبب تولید یک میدان الکتریکی موضعی توسط این نانوذرات میشود که قادر است مستقیماً با میدان الکتریکی مغز ارتباط برقرار کند. از این روش برای انتقال دارو به مغز نیز میتوان استفاده کرد. محققان با قراردادن داروی شیمیدرمانی در یک نانوذره و پوششدهی آن با کیتوسان موفق به ارائه سیستم دارویی شدند که میتواند سلولهای شبه بنیادی سرطان را از بین ببرد. نتایج آزمونهای انجام شده روی حیوانات موفقیتآمیز بوده است. نتایج یافتههای اخیر محققان دانشگاه اوهایو نشان میدهد که نانوذرات بستهبندی شده به همراه داروهای شیمیدرمانی که دارای پوششی از جنس مواد الیگوساکارید است، میتواند برای درمان سرطان به کار رود. این بسته دارویی جدید قادر است سلولهای بنیادی سرطان را از بین ببرد.
محققان با قراردادن داروی شیمیدرمانی در یک نانوذره و پوششدهی آن با کیتوسان موفق به ارائه سیستم دارویی شدند که میتواند سلولهای شبه بنیادی سرطان را از بین ببرد. نتایج آزمونهای انجام شده روی حیوانات موفقیتآمیز بوده است. نتایج یافتههای اخیر محققان دانشگاه اوهایو نشان میدهد که نانوذرات بستهبندی شده به همراه داروهای شیمیدرمانی که دارای پوششی از جنس مواد الیگوساکارید است، میتواند برای درمان سرطان به کار رود. این بسته دارویی جدید قادر است سلولهای بنیادی سرطان را از بین ببرد. محققان امریکایی با تغییر سلولهای ایمنی دندریتی، از تخریب سلولهای پانکراسی تولیدکننده انسولین (سلولهای بتا) در بدن جلوگیری کردهاند که استفاده از این روش میتواند امیدی تازه در تولید واکسن دیابت با استفاده از نانوذرات باشد. دو سال قبل برای اولین بار پژوهشگران روش جدید ایمنیدرمانی تجربی را که میتواند از شروع دیابت نوع یک پیشگیری کند، گزارش کردند. محققان میگویند: این گام مهم نیازمند استخراج سلولهای دندریتی مورد نظر برای دستکاری بعدی آنها و تزریق مجددشان به بدن است.
محققان امریکایی با تغییر سلولهای ایمنی دندریتی، از تخریب سلولهای پانکراسی تولیدکننده انسولین (سلولهای بتا) در بدن جلوگیری کردهاند که استفاده از این روش میتواند امیدی تازه در تولید واکسن دیابت با استفاده از نانوذرات باشد. دو سال قبل برای اولین بار پژوهشگران روش جدید ایمنیدرمانی تجربی را که میتواند از شروع دیابت نوع یک پیشگیری کند، گزارش کردند. محققان میگویند: این گام مهم نیازمند استخراج سلولهای دندریتی مورد نظر برای دستکاری بعدی آنها و تزریق مجددشان به بدن است.
 دانشمندان دانشگاه میسوری ثابت کردهاند درمانی که برای سرطان پروستات از نانوذرات طلای رادیواکتیو استفاده میکند، برای استفاده در سگها بیخطر است.
دانشمندان دانشگاه میسوری ثابت کردهاند درمانی که برای سرطان پروستات از نانوذرات طلای رادیواکتیو استفاده میکند، برای استفاده در سگها بیخطر است. پژوهشگران موسسه فناوری سلطنتی ملبورن، نانوذراتی تولید کردهاند که بسیار ارزان و غیرسمی بوده و از آن میتوان برای رادیودرمانی سرطان استفاده کرد.
پژوهشگران موسسه فناوری سلطنتی ملبورن، نانوذراتی تولید کردهاند که بسیار ارزان و غیرسمی بوده و از آن میتوان برای رادیودرمانی سرطان استفاده کرد. تشخيص زودهنگام سرطان در درمان موفق آن بسيار ضروري است. در بسياري موارد از زندهبيني (بيوپسي) براي تشخيص سرطان استفاده ميشود. «زندهبيني مايع» روش جديدي است که در آن سلولهاي سرطاني موجود در جريان گردش خون (CTCها) از نمونههاي خوني گرفته شده و مورد بررسي قرار ميگيرند؛ با افزايش دقت زندهبيني مايع اين روش ميتواند جايگزين روش تهاجمي زندهبيني در تشخيص تومورهاي متاستاتيک (جابهجا شونده) شود. CTCها ميتوانند در تشخيص انتشار سرطان، پيشبيني وضعيت بيمار و حتي تعيين اثر درمانهاي صورت گرفته مورد استفاده قرار گيرند. با در نظر گرفتن اين واقعيت که خون انسان مجموعه بسيار پيچيدهاي از سلولها و متابوليتهاي مختلف است، تشخيص دقيق CTCها در خون بسيار دشوار است.
تشخيص زودهنگام سرطان در درمان موفق آن بسيار ضروري است. در بسياري موارد از زندهبيني (بيوپسي) براي تشخيص سرطان استفاده ميشود. «زندهبيني مايع» روش جديدي است که در آن سلولهاي سرطاني موجود در جريان گردش خون (CTCها) از نمونههاي خوني گرفته شده و مورد بررسي قرار ميگيرند؛ با افزايش دقت زندهبيني مايع اين روش ميتواند جايگزين روش تهاجمي زندهبيني در تشخيص تومورهاي متاستاتيک (جابهجا شونده) شود. CTCها ميتوانند در تشخيص انتشار سرطان، پيشبيني وضعيت بيمار و حتي تعيين اثر درمانهاي صورت گرفته مورد استفاده قرار گيرند. با در نظر گرفتن اين واقعيت که خون انسان مجموعه بسيار پيچيدهاي از سلولها و متابوليتهاي مختلف است، تشخيص دقيق CTCها در خون بسيار دشوار است.  محققان دانشگاه کاليفرنيا در «ديويس» موفق به سنتز گروه جديدي از نانوذرات شدهاند تا از رهايش زودهنگام دارو جلوگيري كنند؛ اين کار دقت رسانش دارو به تومورهاي سرطاني را افزايش داده و کارايي داروي رهاشده را بهبود ميبخشد. اين پژوهشگران به رهبري پروفسور «کيت لام»، استاد دانشکده بيوشيمي و پزشکي مولکولي، مايسلهاي جديدي به نام مايسلهاي با پاسخ دوگانه و پيوند عرضي بروناتي (BCMs) توليد کردهاند که در پاسخ به محرکهاي خاص، تغييرات فيزيوشيميايي ايجاد ميکنند.
محققان دانشگاه کاليفرنيا در «ديويس» موفق به سنتز گروه جديدي از نانوذرات شدهاند تا از رهايش زودهنگام دارو جلوگيري كنند؛ اين کار دقت رسانش دارو به تومورهاي سرطاني را افزايش داده و کارايي داروي رهاشده را بهبود ميبخشد. اين پژوهشگران به رهبري پروفسور «کيت لام»، استاد دانشکده بيوشيمي و پزشکي مولکولي، مايسلهاي جديدي به نام مايسلهاي با پاسخ دوگانه و پيوند عرضي بروناتي (BCMs) توليد کردهاند که در پاسخ به محرکهاي خاص، تغييرات فيزيوشيميايي ايجاد ميکنند.