..:::: افزایش موفقیت جراحی پیوند قرنیه چشم با نانوذرات ::::..
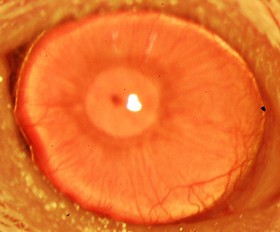
محققان با استفاده از نانوذرات زیستتخریبپذیر حاوی کورتیکواستروئید، شانس موفقیت جراحی پیوند قرنیه چشم را در موشهای آزمایشگاهی افزایش دادند. نانوذرات حاوی دارو میتوانند در عمل جراحی پیوند قرنیه چشم به کار گرفته شوند. نتایج آزمونهای آزمایشگاهی انجام شده روی حیوانات نشان میدهد که این نانوذرات اثر مثبتی در پیوند قرنیه دارند.
هر سال در آمریکا بیش از 48 هزار پیوند قرنیه انجام میشود. این در حالی است که پیوند کلیه 16 هزار و پیوند قلب 2100 مورد است. 10 درصد از این 48 هزار پیوند به دلیل مشکل عدم رعایت نکات پزشکی با شکست مواجه میشود که این موضوع هزینه سنگینی برای بخش پزشکی و درمانی و همچنین بیمار دارد. محققان بیمارستان جان هاپکینز موفق به ارائه نانوذرات زیستتخریبپذیری شدند که میتواند مانع پسزدن قرنیه پیوند خورده شود. با این یافته محققان، شانس موفقیت پیوند قرنیه به شدت افزایش مییابد. سرپیچی از دستورات پزشکی توسط بیمار، یکی از چالشهای بزرگ بخش درمانی است. 60 تا 80 درصد بیماران، داروهای تجویز شده را براساس نظر پزشک مصرف نمیکنند.
محققان با آزمایشهای انجام شده روی موشها به دنبال راههای کاهش فشار روی بخش پیوند خورده هستند. پژوهشگران موشهای آزمایشگاهی که پیوند قرنیه روی آنها انجام شده را به چهار دسته تقسیم کردند. به یکی از این گروهها، به مدت 9 هفته از این نانوذرات زیستتخریبپذیر حاوی کورتیکواستروئید تزریق کردند و به سه گروه دیگر به ترتیب محلول نمک، نانوذرات دارای مسکن و محلول سولفات سدیم حاوی دکسامتازون آزاد تزریق کردند. نتایج نشان داد موشهای دسته اول شرایط بهتری بعد از عمل داشتهاند. در این موشها هیچ اثری از تورم وجود نداشت و رشد رگهای خونی ناخواسته نیز در آنها بسیار کم بود. نانوذرات زیستتخریبپذیر حاوی کورتیکواستروئید میتواند میزان پسزدن قرنیه پیوند خورده را به صفر برساند. یکی از مزایای این روش آن است که میزان داروی تجویز شده به بیمار بعد از عمل کم شده که این موضوع موفقیت عمل را افزایش میدهد.
 یک روش واکسینه جدید با استفاده از نانوذرات، میتواند کلیدی برای مقابله با ویروسهای دستگاه عصبی باشد که یکی از متداولترین بیماریهایی است که از طریق خوردن غذا وارد معده میشود. محققان استرالیایی با کاربرد نانوذرات از طریق واکسنها، آنتیژنهای پپتیدی را برای رشد بیشتر به بدن وارد کردهاند. آنها در این تحقیق آنتیژنهای رترو ویروس را به درون ذرات P وارد کردهاند تا در برابر این ویروس مانند نوروویروسها در موش ایمنی ایجاد کنند.
یک روش واکسینه جدید با استفاده از نانوذرات، میتواند کلیدی برای مقابله با ویروسهای دستگاه عصبی باشد که یکی از متداولترین بیماریهایی است که از طریق خوردن غذا وارد معده میشود. محققان استرالیایی با کاربرد نانوذرات از طریق واکسنها، آنتیژنهای پپتیدی را برای رشد بیشتر به بدن وارد کردهاند. آنها در این تحقیق آنتیژنهای رترو ویروس را به درون ذرات P وارد کردهاند تا در برابر این ویروس مانند نوروویروسها در موش ایمنی ایجاد کنند.  دانشمندان آمریکایی در روش جدید خود، نواحی خاص سلولهای سرطانی را با داروهای مختلف و به طور همزمان هدف قرار دادهاند. این محققان شیوهای را برای تولید نانوذراتی ارائه دادهاند که دو داروی قاتل سرطان را به درون بدن حمل کرده و این داروها را به بخشهای مختلف سلولهای سرطانی تحویل میدهند. محققان دانشگاه ایالتی کارولینای شمالی و دانشگاه کارولینای شمالی در چاپلهیل، این روش را طراحی کردهاند. دکتر ژن گو، نویسنده ارشد این مقاله گفت: با آزمایش بر روی موشها، روش ما در مقایسه با شیوههای درمانی عادی منجر به پیشرفت مهمی در کاهش تومور سرطان پستان شد.
دانشمندان آمریکایی در روش جدید خود، نواحی خاص سلولهای سرطانی را با داروهای مختلف و به طور همزمان هدف قرار دادهاند. این محققان شیوهای را برای تولید نانوذراتی ارائه دادهاند که دو داروی قاتل سرطان را به درون بدن حمل کرده و این داروها را به بخشهای مختلف سلولهای سرطانی تحویل میدهند. محققان دانشگاه ایالتی کارولینای شمالی و دانشگاه کارولینای شمالی در چاپلهیل، این روش را طراحی کردهاند. دکتر ژن گو، نویسنده ارشد این مقاله گفت: با آزمایش بر روی موشها، روش ما در مقایسه با شیوههای درمانی عادی منجر به پیشرفت مهمی در کاهش تومور سرطان پستان شد.  محققان دانشگاه کالیفرنیا روش دارورسانی جدیدی را ارائه کردند که میتوان با استفاده از آن سلولهای سرطان پانکراس را از بین برد. سرطان پانکراس یک بیماری کشنده بود که تا رسیدن به مراحل پیشرفته بیماری امکان شناسایی آن وجود نداشت. روشهای درمان این بیماری بسیار محدود و نرخ موفقیت آنها نیز بسیار اندک است. برای این که بتوان روشهای جدیدی را برای درمان این بیماری پیدا کرد، باید بتوان ابتدا آن را شناسایی کرد، در حالی که شناسایی این بیماری چند سال پس از آغاز آن قابل انجام است.
محققان دانشگاه کالیفرنیا روش دارورسانی جدیدی را ارائه کردند که میتوان با استفاده از آن سلولهای سرطان پانکراس را از بین برد. سرطان پانکراس یک بیماری کشنده بود که تا رسیدن به مراحل پیشرفته بیماری امکان شناسایی آن وجود نداشت. روشهای درمان این بیماری بسیار محدود و نرخ موفقیت آنها نیز بسیار اندک است. برای این که بتوان روشهای جدیدی را برای درمان این بیماری پیدا کرد، باید بتوان ابتدا آن را شناسایی کرد، در حالی که شناسایی این بیماری چند سال پس از آغاز آن قابل انجام است.  محققان دانشگاه مینهسوتا با استفاده از نانوذرات به عنوان حامل، عوارض ماده شیمیایی TNF-a را که میتواند رگهای خونی اطراف تومور را از بین ببرد، به حداقل رساندهاند. در سالهای اخیر محققان موفق شدند روشی برای از بین بردن رگهای پیرامون تومورها پیدا کنند با این کار میتوان تومورها را از بین برد. برای این کار از مواد شیمیایی مختلف استفاده میشود. یکی از این ترکیبات کاچکسین یا TNF-a است که نتایج بسیار خوبی داده است، مشکل این ماده سمی بودن آن است که میتواند عوارض جانبی داشته باشد. برای کاهش سمیت این ماده میتوان از نانوذرات طلا استفاده کرد. این نانوذرات میتوانند به عنوان حامل این ماده دارو را در محل مورد نظر رهاسازی کنند. این فرآیند فاز اول تست بالینی را پشت سر گذاشته است.
محققان دانشگاه مینهسوتا با استفاده از نانوذرات به عنوان حامل، عوارض ماده شیمیایی TNF-a را که میتواند رگهای خونی اطراف تومور را از بین ببرد، به حداقل رساندهاند. در سالهای اخیر محققان موفق شدند روشی برای از بین بردن رگهای پیرامون تومورها پیدا کنند با این کار میتوان تومورها را از بین برد. برای این کار از مواد شیمیایی مختلف استفاده میشود. یکی از این ترکیبات کاچکسین یا TNF-a است که نتایج بسیار خوبی داده است، مشکل این ماده سمی بودن آن است که میتواند عوارض جانبی داشته باشد. برای کاهش سمیت این ماده میتوان از نانوذرات طلا استفاده کرد. این نانوذرات میتوانند به عنوان حامل این ماده دارو را در محل مورد نظر رهاسازی کنند. این فرآیند فاز اول تست بالینی را پشت سر گذاشته است.  محققان مؤسسه تحقیقات کاربردی پلیمر فرانهوفر آلمان شیوه جدیدی ابداع کردهاند که به نمایش مواد حاوی نانوذرات با قابلیت کشتن انتخابی سلولهای تومور میپردازد. محققان از آبگریزها یا وزیکولهای چربی نامحلول در آب به عنوان حاملهای دارویی کوچک 200 تا 250 نانومتری استفاده کردند. این حاملها از لحاظ زیستی در بدن پس از استقرار قابل تخریب و تجزیه هستند. از پلیمرها برای تثبیت نانوپوشش استفاده میشود که از مولکولهای بسیار خاص و به رسمیت شناخته شده توسط سلولهای تومور برخوردارند. این پوشش نانوذرات که متخصصان آن را ویزکول مینامند، از ساختاری شبیه سلول برخوردارند.
محققان مؤسسه تحقیقات کاربردی پلیمر فرانهوفر آلمان شیوه جدیدی ابداع کردهاند که به نمایش مواد حاوی نانوذرات با قابلیت کشتن انتخابی سلولهای تومور میپردازد. محققان از آبگریزها یا وزیکولهای چربی نامحلول در آب به عنوان حاملهای دارویی کوچک 200 تا 250 نانومتری استفاده کردند. این حاملها از لحاظ زیستی در بدن پس از استقرار قابل تخریب و تجزیه هستند. از پلیمرها برای تثبیت نانوپوشش استفاده میشود که از مولکولهای بسیار خاص و به رسمیت شناخته شده توسط سلولهای تومور برخوردارند. این پوشش نانوذرات که متخصصان آن را ویزکول مینامند، از ساختاری شبیه سلول برخوردارند. 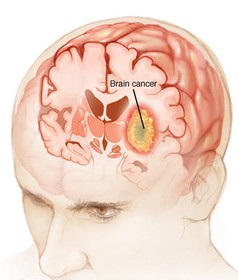 یک تیم تحقیقاتی در مرکز سرطان جانسون موفق به ارائه یک سیستم دارویی شامل نانوذرات الماس شدند که میتواند سلولهای سرطان مغز را از بین ببرد بدون این که به سلولهای سالم اطراف اثری داشته باشد. عوامل شیمیدرمانی نظیر دوکسوروبیسین دارای عوارض جانبی زیادی روی بدن هستند که با سیستم دارویی جدید که در آن از نانوذرات الماس به عنوان حمل کننده داروی شیمیدرمانی برای رهایش مستقیم در تومور مغز استفاده شده، عوارض جانبی دارو کاهش یافته و اثربخشی آن بالا رفته است.
یک تیم تحقیقاتی در مرکز سرطان جانسون موفق به ارائه یک سیستم دارویی شامل نانوذرات الماس شدند که میتواند سلولهای سرطان مغز را از بین ببرد بدون این که به سلولهای سالم اطراف اثری داشته باشد. عوامل شیمیدرمانی نظیر دوکسوروبیسین دارای عوارض جانبی زیادی روی بدن هستند که با سیستم دارویی جدید که در آن از نانوذرات الماس به عنوان حمل کننده داروی شیمیدرمانی برای رهایش مستقیم در تومور مغز استفاده شده، عوارض جانبی دارو کاهش یافته و اثربخشی آن بالا رفته است.  یک گروه تحقیقاتی از دانشگاه بوستون و دانشگاه ایالتی پنسیلوانیا موفق به ابداع روشی شدند که با استفاده از آن میتوان داروی ترمیمکننده را به درون میکروترکهای موجود در استخوان وارد کرد. برای ترمیم استخوان با دارو، ترکیبات دارویی وارد خون میشوند تا به ترکهای استخوان برسند.
یک گروه تحقیقاتی از دانشگاه بوستون و دانشگاه ایالتی پنسیلوانیا موفق به ابداع روشی شدند که با استفاده از آن میتوان داروی ترمیمکننده را به درون میکروترکهای موجود در استخوان وارد کرد. برای ترمیم استخوان با دارو، ترکیبات دارویی وارد خون میشوند تا به ترکهای استخوان برسند.  یک تیم تحقیقاتی با استفاده از عصاره یک گیاه موفق به تولید نانوذرات طلا با خواص آنتیباکتریال شده است. نانوذرات طلا کاربرد وسیعی در پزشکی دارند، اما تولید آنها بسیار پرهزینه است. پژوهشگران دانشگاه مورداک، روش زیست سازگاری را برای تولید نانوذرات آنتیباکتریال طلا یافتند. از این نانوذرات میتوان در پزشکی استفاده کرد.
یک تیم تحقیقاتی با استفاده از عصاره یک گیاه موفق به تولید نانوذرات طلا با خواص آنتیباکتریال شده است. نانوذرات طلا کاربرد وسیعی در پزشکی دارند، اما تولید آنها بسیار پرهزینه است. پژوهشگران دانشگاه مورداک، روش زیست سازگاری را برای تولید نانوذرات آنتیباکتریال طلا یافتند. از این نانوذرات میتوان در پزشکی استفاده کرد. 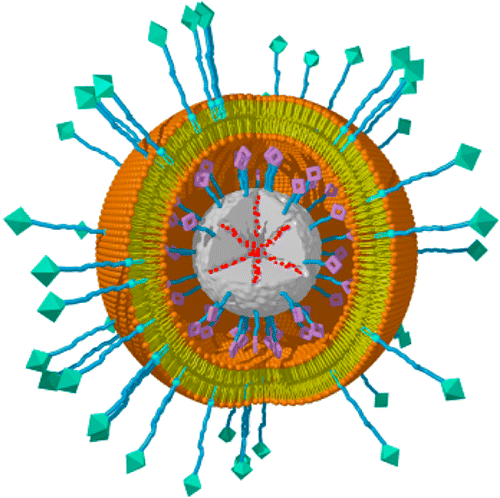 محققان آلمانی روشی برای تولید نانوذرات ایجاد کردهاند که میتواند با تطبیقپذیری بالا برای دارورسانی به سلولهای سرطانی گوناگون مورد استفاده قرار گیرد. این روش جدید امکان ساخت نانوذرات را با طراحیهای ویژه برای کاربردی به خصوص فراهم میکند. این ذرات میتوانند به راحتی با عوامل شیمیایی گوناگون بارگذاری شده و با برچسبگذاری برای یک گونه خاص سلول مورد استفاده قرار گیرند؛ بنابراین این ذرات به سلولهای سرطانی مشخصی چسبیده و دارو را آزاد میکنند. بدین صورت داروی ضدسرطان مستقیما و به طور خاص به سلول سرطانی خواهد رسید.
محققان آلمانی روشی برای تولید نانوذرات ایجاد کردهاند که میتواند با تطبیقپذیری بالا برای دارورسانی به سلولهای سرطانی گوناگون مورد استفاده قرار گیرد. این روش جدید امکان ساخت نانوذرات را با طراحیهای ویژه برای کاربردی به خصوص فراهم میکند. این ذرات میتوانند به راحتی با عوامل شیمیایی گوناگون بارگذاری شده و با برچسبگذاری برای یک گونه خاص سلول مورد استفاده قرار گیرند؛ بنابراین این ذرات به سلولهای سرطانی مشخصی چسبیده و دارو را آزاد میکنند. بدین صورت داروی ضدسرطان مستقیما و به طور خاص به سلول سرطانی خواهد رسید. 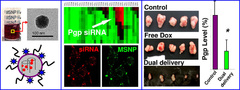 بر اساس آزمایشات جدید محققان دانشگاه کالیفرنیا، نانوذرات متخلخل سیلیکا میتوانند برای غلبه بر مقاومت دارویی در سلولهای سرطانی مورد استفاده قرار گیرند. به گزارش سرویس فناوری ایسنا، منافذ این نانوذرات میتوانند برای جابهجایی داروی ضدسرطان دوکسوروبیسین و نوع خاصی از ریبونوکلئیک اسید (RNA) استفاده شود. در مرحله بعد این دو دارو به طور موثری در نواحی توموری، در موشهایی که سلولهای سرطانی سینه مقاوم در برابر دارو به آنها پیوند زده شده است، آزاد شدند. اکثر روشهای شیمیدرمانی شامل ترکیب چند داروی معالج برای جلوگیری از مقاومت دارویی در بیماران مبتلا به سرطان است. با این وجود، سلولهای سرطانی میتوانند خود را در مقابل بیشتر داروهای مورد استفاده سازگار و مقاوم کنند؛ مسالهای که در نهایت منجر به شکست طرح درمان میشود.
بر اساس آزمایشات جدید محققان دانشگاه کالیفرنیا، نانوذرات متخلخل سیلیکا میتوانند برای غلبه بر مقاومت دارویی در سلولهای سرطانی مورد استفاده قرار گیرند. به گزارش سرویس فناوری ایسنا، منافذ این نانوذرات میتوانند برای جابهجایی داروی ضدسرطان دوکسوروبیسین و نوع خاصی از ریبونوکلئیک اسید (RNA) استفاده شود. در مرحله بعد این دو دارو به طور موثری در نواحی توموری، در موشهایی که سلولهای سرطانی سینه مقاوم در برابر دارو به آنها پیوند زده شده است، آزاد شدند. اکثر روشهای شیمیدرمانی شامل ترکیب چند داروی معالج برای جلوگیری از مقاومت دارویی در بیماران مبتلا به سرطان است. با این وجود، سلولهای سرطانی میتوانند خود را در مقابل بیشتر داروهای مورد استفاده سازگار و مقاوم کنند؛ مسالهای که در نهایت منجر به شکست طرح درمان میشود. محققان کلینیک مایو، مکانیسم چگونگی کارآمدکردن نانوذرات طلا علیه سلولهای سرطان تخمدان را شناسایی کردند. نانوذرات طلای باردار مثبت، معمولا برای سلولها سمی هستند، اما سلولهای سرطانی از مسمومشدن توسط آنها، اجتناب میکنند. مطالعه جدید مکانیسم نوینی را شناسایی میکند که با جلوگیری از مرگ سلول یا آپوپتوز(که هنگام برخورد با نانوذرات باردار رخ میدهد) از سلولهای سرطانی تخمدان محافظت میکند. با اعمال بارهای یونی مثبت بر روی سطح سلول، نانوذرات به عنوان نابودگر سلولهای توموری عمل کرده در حالی که سلولهای سالم را به حال خود رها میکنند.
محققان کلینیک مایو، مکانیسم چگونگی کارآمدکردن نانوذرات طلا علیه سلولهای سرطان تخمدان را شناسایی کردند. نانوذرات طلای باردار مثبت، معمولا برای سلولها سمی هستند، اما سلولهای سرطانی از مسمومشدن توسط آنها، اجتناب میکنند. مطالعه جدید مکانیسم نوینی را شناسایی میکند که با جلوگیری از مرگ سلول یا آپوپتوز(که هنگام برخورد با نانوذرات باردار رخ میدهد) از سلولهای سرطانی تخمدان محافظت میکند. با اعمال بارهای یونی مثبت بر روی سطح سلول، نانوذرات به عنوان نابودگر سلولهای توموری عمل کرده در حالی که سلولهای سالم را به حال خود رها میکنند.