فناوری نانو به کمک دیابتیها میآید
 محققان در دانشگاه لیدز انگلستان با بهره گیری از فناوری جدید، قطعهای شیشه سیلیکا را با روش نانو طراحی کردهاند که وقتی نور لیزری با قدرت پایین به یونهای آن برخورد میکند، در طیف نور مادونقرمز، نور فلورسانس تولید میکند. در این حسگر لیزری جدید، میزان قندخون بدون سوراخ کردن پوست قابل کنترل است. در حال حاضر، بسیاری از بیماران دیابتی باید با سوراخکردن انگشتان خود، قرار دادن قطره خون خارج شده روی نوار آزمایش و پردازش نتایج به کمک دستگاه تست قندخون سیار، میزان قندخون خود را اندازهگیری کنند. این فرآیند ممکن است ناراحتکننده و آلودهکننده باشد و بارها به صورت روزانه تکرار شود.
محققان در دانشگاه لیدز انگلستان با بهره گیری از فناوری جدید، قطعهای شیشه سیلیکا را با روش نانو طراحی کردهاند که وقتی نور لیزری با قدرت پایین به یونهای آن برخورد میکند، در طیف نور مادونقرمز، نور فلورسانس تولید میکند. در این حسگر لیزری جدید، میزان قندخون بدون سوراخ کردن پوست قابل کنترل است. در حال حاضر، بسیاری از بیماران دیابتی باید با سوراخکردن انگشتان خود، قرار دادن قطره خون خارج شده روی نوار آزمایش و پردازش نتایج به کمک دستگاه تست قندخون سیار، میزان قندخون خود را اندازهگیری کنند. این فرآیند ممکن است ناراحتکننده و آلودهکننده باشد و بارها به صورت روزانه تکرار شود.
فناوری جدیدی از دستگاه کوچکی بهره میگیرد که برای اندازهگیری میزان قندخون بدون نفوذ در پوست از لیزری با قدرت پایین استفاده میکند. درمقایسه با سوراخکردن انگشت، این فناوری جانشینی سادهتر و بدون درد را برای بیماران فراهم میکند. محققان میگویند: وقتی این شیشه در تماس با پوست کاربر قرار میگیرد، دامنه سیگنال فلورسانس متناسب با غلظت قندخون فرد تغییر میکند. این دستگاه مدت زمانی را که فلورسانس ادامه دارد، ارزیابی کرده و از آن برای محاسبه میزان قند موجود در جریان خون فرد استفاده میکند، بدون اینکه به سوزن نیاز داشته باشد. این روند کمتر از 30 ثانیه طول میکشد.
شیشهای که در حسگرها استفاده شده بادوام است و مشابه با شیشهای عمل میکند که در تلفنهای هوشمند استفاده میشود. به همین دلیل، این دستگاه ارزانتر و مقرونبهصرفهتر است؛ چون در مقایسه با سیستمهای خودکنترلی فعلی، هزینههای استفاده از این دستگاه پایینتر است. محققان میگویند: این فناوری از قابلیتهای نظارتی مستمری برخوردار است که آن را به عنوان دستگاهی پوشیدنی به گزینهای ایدهآل برای همهگیرشدن تبدیل میکند و میتواند به بهبود زندگی میلیونها انسان کمک کند، چون آنها را قادر میسازد تا بدون نیاز به هیچ اتصالی، پیوسته میزان قندخون خود را کنترل کنند.
به گفته محققان، استفاده از این روش در مقایسه با کنترلکنندههای مستمر تهاجمی که از حسگرهای کاشته شده استفاده کرده و باید به طور مرتب تعویض شوند، گزینه سادهتر و ارزانتری است و برخلاف روش متداول، این فناوری جدید و غیرتهاجمی میتواند بهصورت پیوسته میزان قندخون را کنترل کند.
محققان با تاکید بر اینکه که فناوری مذکور جانشینی برای آزمایش به روش سوراخکردن انگشت محسوب میشود، تصریح کردند: استفاده از این سامانه، این قابلیت را نیز برای افراد دیابتی فراهم میکند تا به صورت مستمر قندخون خود را ارزیابی کنند. یعنی زمانی که اقدامی فوری ضرورت دارد، خیلی سریع به بیمار هشدار داده میشود.
آنها میگویند: استفاده از این شیوه به دیابتیها کمک میکند تا خودتنظیمی داشته باشند و درمان اورژانسی را به حداقل میرساند. به ادعای دانشمندان، این دستگاه پوشیدنی تنها یک گام با محصولی فاصله دارد که هشدارها را به تلفنهای همراه هوشمند ارسال میکند یا مقادیر قندخون را مستقیم به پزشک اطلاع داده و به آنها اجازه میدهد تا نحوه مدیریت بیماری، توسط فرد دیابتی را ثبت و ضبط کنند.
محققان میگویند: این فناوری منحصر بهفرد به میلیونها انسان اجازه میدهد تا بیماری دیابت خود را بهتر مدیریت کنند. تکامل نهایی دو محصول متمایز (محصول لمسی، انگشتی و محصول پوشیدنی) این امکان را در اختیار مبتلایان به دیابتهای نوع 1 و 2 قرارمیدهد تا از دستگاهی استفاده کنند که بیشترین تناسب را با سبک زندگی آنها دارد. در حال حاضر نوع رومیزی این دستگاه به صورت آزمایشی در بررسیهای بالینی استفاده میشود اما محققان قصد دارند دو نوع دستگاه برای بازار بسازند. یک دستگاه که به صورت لمس، انگشتی و شبیه به ماوس رایانه است و دیگری که مدلی پوشیدنی جهت کنترل پیوسته قند است.
نتایج بررسیهای بالینی آزمایشی به خوبی نشان میدهد که این فناوری نظارتی جدید، مانند فناوریهای متداول از پتانسیل اجراییشدن برخوردار است. آزمایشهای بالینی بیشتر و بهینهسازی محصول به منظور تایید قانونی این محصول و نیز قبلاز آمادهسازی این فناوری برای ورود به بازار ضرورت دارند. محققان می گویند: کنترل غیرتهاجمی، به ویژه در بیماران جوانی که به دیابت نوع یک مبتلا هستند بسیار ارزشمند است. دراین گروه، افرادی که به کنترل شدید و دقیق قند نیاز دارند مثل زنان جوانی که باردار هستند یا افرادی کهبه افت مکرر قندخون مبتلا هستند، از این فناوری بهرهی بیشتری میبرند.
 پژوهشگران نانولولههای کربنی، الیافی نرم و انعطافپذیر و درعینحال محکم ساختهاند که در بافت قلب، برای درمان نامنظمی ضربان قلب کاربرد دارند.
پژوهشگران نانولولههای کربنی، الیافی نرم و انعطافپذیر و درعینحال محکم ساختهاند که در بافت قلب، برای درمان نامنظمی ضربان قلب کاربرد دارند. محققان ژاپنی با استفاده از پوششدهی نانومیلههای طلا با نوعی پروتئین، موفق به ساخت دارویی برای تسکین درد شدند. این دارو به صورت تزریق موضعی وارد بدن بیمار میشود. یک گروه تحقیقاتی از مؤسسه علوم مواد سلولی دانشگاه کیوتو موفق به ارائه روشی شدند که در آن از نانومیلههای طلا برای هدفگیری گیرندههای درد استفاده میشود.
محققان ژاپنی با استفاده از پوششدهی نانومیلههای طلا با نوعی پروتئین، موفق به ساخت دارویی برای تسکین درد شدند. این دارو به صورت تزریق موضعی وارد بدن بیمار میشود. یک گروه تحقیقاتی از مؤسسه علوم مواد سلولی دانشگاه کیوتو موفق به ارائه روشی شدند که در آن از نانومیلههای طلا برای هدفگیری گیرندههای درد استفاده میشود.  محققان با استفاده از نانوذرات زیستتخریب پذیر موفق به ارائه روش درمانی جدیدی برای ژندرمانی شدند که امکان درمان بیماریهای ژنتیکی ریوی را فراهم میکند.
محققان با استفاده از نانوذرات زیستتخریب پذیر موفق به ارائه روش درمانی جدیدی برای ژندرمانی شدند که امکان درمان بیماریهای ژنتیکی ریوی را فراهم میکند.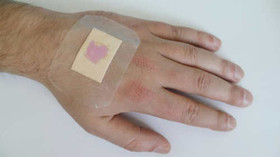 دانشمندان دانشگاه صنعتی سوینبرن انگلستان پوششی ساختهاند که باکتریها را از داخل زخمها جذب کرده و کاربر میتواند ماده و میکروبها را همزمان دور بیندازد. محققان از فیبرهای پلیاستایرن الکتروریسی استفاده کردند که تا 100 برابر نازکتر از موی انسان بودند. تورهای ساختهشده از این فیبرها بر روی فیلمهای باکتری به نام Staphylococcus aureus قرار داده شدند که این باکتری اغلب زخمها را عفونی میکند.
دانشمندان دانشگاه صنعتی سوینبرن انگلستان پوششی ساختهاند که باکتریها را از داخل زخمها جذب کرده و کاربر میتواند ماده و میکروبها را همزمان دور بیندازد. محققان از فیبرهای پلیاستایرن الکتروریسی استفاده کردند که تا 100 برابر نازکتر از موی انسان بودند. تورهای ساختهشده از این فیبرها بر روی فیلمهای باکتری به نام Staphylococcus aureus قرار داده شدند که این باکتری اغلب زخمها را عفونی میکند. محققان آمریکایی با تزریق دستهای از نانوذرات خاص به مغز موشها، موفق شدهاند نوعی ارتباط مستقیم و بیسیم با نورونهای شبکه عصبی برقرار کنند. اعمال یک میدان مغناطیسی خارجی، سبب تولید یک میدان الکتریکی موضعی توسط این نانوذرات میشود که قادر است مستقیماً با میدان الکتریکی مغز ارتباط برقرار کند. از این روش برای انتقال دارو به مغز نیز میتوان استفاده کرد.
محققان آمریکایی با تزریق دستهای از نانوذرات خاص به مغز موشها، موفق شدهاند نوعی ارتباط مستقیم و بیسیم با نورونهای شبکه عصبی برقرار کنند. اعمال یک میدان مغناطیسی خارجی، سبب تولید یک میدان الکتریکی موضعی توسط این نانوذرات میشود که قادر است مستقیماً با میدان الکتریکی مغز ارتباط برقرار کند. از این روش برای انتقال دارو به مغز نیز میتوان استفاده کرد. محققان موفق به ساخت نانوابزاری برای رهاسازی هوشمند انسولین در بیماران دیابتی شدند. این ابزار به اندازه یک سکه بوده و حاوی صد سوزن است که انسولین درون آن قرار دارد. نتایج یافتههای اخیر محققان دانشگاه کارولینای شمالی نشان میدهد که میتوان از بستههای هوشمند حاوی انسولین برای درمان بیماران دیابتی استفاده کرد. این بسته قادر است انسولین را با دوزهای مشخصی وارد جریان خون کند.
محققان موفق به ساخت نانوابزاری برای رهاسازی هوشمند انسولین در بیماران دیابتی شدند. این ابزار به اندازه یک سکه بوده و حاوی صد سوزن است که انسولین درون آن قرار دارد. نتایج یافتههای اخیر محققان دانشگاه کارولینای شمالی نشان میدهد که میتوان از بستههای هوشمند حاوی انسولین برای درمان بیماران دیابتی استفاده کرد. این بسته قادر است انسولین را با دوزهای مشخصی وارد جریان خون کند.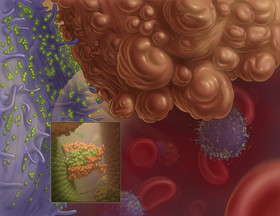 محققان ژاپنی با ادغام دانش زیستی و نانویی خود به کپسولهای جدیدی دست یافتند که علاوه بر تشخیص دقیق محل تومور، میتواند برای تحویل دارو نیز مورد استفاده قرار گیرد. پلیمرسامزها کپسولهایی توخالی، ترکیبی و نانویی هستند که پیش از این ظرفیت بالقوه آنها در حوزه تحویل دارو مورد بررسی قرار گرفته است. پیآیسیسامزها دسته جدیدی از پلیمرسامزها هستند و به تازگی در دانشگاه توکیو توسعه داده شدهاند. این مواد از اختلاط گروههای الکترولیتی متشکل از یونهای منفی و مثبت ساخته میشوند. پیآیسیسامزها میتوانند درون جریان خون به مدت زمان زیادی و بدون مشکل خاصی باقی بمانند. آنها همچنین میتوانند برای تحویل مواد انحلالپذیر در آب به اندامهای هدف (به عنوان مثال سایتهای تومور) مورد استفاده قرار گیرند.
محققان ژاپنی با ادغام دانش زیستی و نانویی خود به کپسولهای جدیدی دست یافتند که علاوه بر تشخیص دقیق محل تومور، میتواند برای تحویل دارو نیز مورد استفاده قرار گیرد. پلیمرسامزها کپسولهایی توخالی، ترکیبی و نانویی هستند که پیش از این ظرفیت بالقوه آنها در حوزه تحویل دارو مورد بررسی قرار گرفته است. پیآیسیسامزها دسته جدیدی از پلیمرسامزها هستند و به تازگی در دانشگاه توکیو توسعه داده شدهاند. این مواد از اختلاط گروههای الکترولیتی متشکل از یونهای منفی و مثبت ساخته میشوند. پیآیسیسامزها میتوانند درون جریان خون به مدت زمان زیادی و بدون مشکل خاصی باقی بمانند. آنها همچنین میتوانند برای تحویل مواد انحلالپذیر در آب به اندامهای هدف (به عنوان مثال سایتهای تومور) مورد استفاده قرار گیرند. محققان با استفاده از کپسوله کردن داروی ضد انعقاد در یک ساختار نانومتری، اقدام به تولید نانودارویی برای درمان بیماران مبتلا به سکته قلبی کردند. این دارو میتواند بخشهایی که خون در آنجا منعقد شده را باز کند. پژوهشگران استرالیایی با استفاده از حمایت مالی اختصاص یافته از سوی بنیاد ملی قلب، موفق شدند گامی به سوی درمان مشکلات قلبی با کمک فناوری نانو بردارند.
محققان با استفاده از کپسوله کردن داروی ضد انعقاد در یک ساختار نانومتری، اقدام به تولید نانودارویی برای درمان بیماران مبتلا به سکته قلبی کردند. این دارو میتواند بخشهایی که خون در آنجا منعقد شده را باز کند. پژوهشگران استرالیایی با استفاده از حمایت مالی اختصاص یافته از سوی بنیاد ملی قلب، موفق شدند گامی به سوی درمان مشکلات قلبی با کمک فناوری نانو بردارند. محققان با قراردادن داروی شیمیدرمانی در یک نانوذره و پوششدهی آن با کیتوسان موفق به ارائه سیستم دارویی شدند که میتواند سلولهای شبه بنیادی سرطان را از بین ببرد. نتایج آزمونهای انجام شده روی حیوانات موفقیتآمیز بوده است. نتایج یافتههای اخیر محققان دانشگاه اوهایو نشان میدهد که نانوذرات بستهبندی شده به همراه داروهای شیمیدرمانی که دارای پوششی از جنس مواد الیگوساکارید است، میتواند برای درمان سرطان به کار رود. این بسته دارویی جدید قادر است سلولهای بنیادی سرطان را از بین ببرد.
محققان با قراردادن داروی شیمیدرمانی در یک نانوذره و پوششدهی آن با کیتوسان موفق به ارائه سیستم دارویی شدند که میتواند سلولهای شبه بنیادی سرطان را از بین ببرد. نتایج آزمونهای انجام شده روی حیوانات موفقیتآمیز بوده است. نتایج یافتههای اخیر محققان دانشگاه اوهایو نشان میدهد که نانوذرات بستهبندی شده به همراه داروهای شیمیدرمانی که دارای پوششی از جنس مواد الیگوساکارید است، میتواند برای درمان سرطان به کار رود. این بسته دارویی جدید قادر است سلولهای بنیادی سرطان را از بین ببرد. محققان کرهای با استفاده از نانولولهکربنی موفق به ساخت نانوحسگری شدند که قادر به شناسایی احساسات انسان است. این حسگر بسیار حساس میتواند فعالیتهای مختلفی انجام دهد. این حسگر به سازندگان ربات کمک میکند تا رباتهایی شبیه انسان بسازند. نای یونگ لی و همکارانش معتقدند که یکی از راههای ایجاد برهمکنش میان انسان و ربات، ایجاد توانایی خواندن احساسات و پاسخ به آن توسط کامپیوتر است. یکی از روشها برای رسیدن به چنین محصولی، ساخت حسگرهای بصری است که میتواند احساس افراد را از روی اخم یا لبخند دریابد. این حسگرهای بسیار گرانقیمت، پیچیدگی بالایی دارند.
محققان کرهای با استفاده از نانولولهکربنی موفق به ساخت نانوحسگری شدند که قادر به شناسایی احساسات انسان است. این حسگر بسیار حساس میتواند فعالیتهای مختلفی انجام دهد. این حسگر به سازندگان ربات کمک میکند تا رباتهایی شبیه انسان بسازند. نای یونگ لی و همکارانش معتقدند که یکی از راههای ایجاد برهمکنش میان انسان و ربات، ایجاد توانایی خواندن احساسات و پاسخ به آن توسط کامپیوتر است. یکی از روشها برای رسیدن به چنین محصولی، ساخت حسگرهای بصری است که میتواند احساس افراد را از روی اخم یا لبخند دریابد. این حسگرهای بسیار گرانقیمت، پیچیدگی بالایی دارند.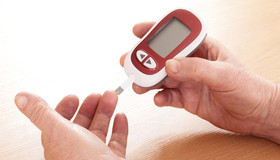 محققان امریکایی با تغییر سلولهای ایمنی دندریتی، از تخریب سلولهای پانکراسی تولیدکننده انسولین (سلولهای بتا) در بدن جلوگیری کردهاند که استفاده از این روش میتواند امیدی تازه در تولید واکسن دیابت با استفاده از نانوذرات باشد. دو سال قبل برای اولین بار پژوهشگران روش جدید ایمنیدرمانی تجربی را که میتواند از شروع دیابت نوع یک پیشگیری کند، گزارش کردند. محققان میگویند: این گام مهم نیازمند استخراج سلولهای دندریتی مورد نظر برای دستکاری بعدی آنها و تزریق مجددشان به بدن است.
محققان امریکایی با تغییر سلولهای ایمنی دندریتی، از تخریب سلولهای پانکراسی تولیدکننده انسولین (سلولهای بتا) در بدن جلوگیری کردهاند که استفاده از این روش میتواند امیدی تازه در تولید واکسن دیابت با استفاده از نانوذرات باشد. دو سال قبل برای اولین بار پژوهشگران روش جدید ایمنیدرمانی تجربی را که میتواند از شروع دیابت نوع یک پیشگیری کند، گزارش کردند. محققان میگویند: این گام مهم نیازمند استخراج سلولهای دندریتی مورد نظر برای دستکاری بعدی آنها و تزریق مجددشان به بدن است.



 محققان یکی از شرکتهای فعال در حوزه ساخت ادوات و مواد مورد استفاده در پرتونگاری اشعه ایکس موفق به ساخت محصول جدیدی برای افزایش دید در ادوات آندوسکوپی مبتنی بر پرتونگاری اشعه ایکس شدند. از محصول جدید شرکت Radiopaque Solutions که در آن از نانوذرات استفاده شده است، در دستگاههای آندوسکوپی برای مشاهده بدن استفاده میشود. این محصول میتواند میزان دوز تابشی را کاهش داده، در نتیجه اثرات جانبی این روش را به حداقل برساند. با استفاده از این ابزار جدید، جراحان میتوانند در طول عمل جراحی دید بهتری داشته باشند. این محصول جایگزین باندهای رایج یکبار مصرف فعلی میشود. توماس لانچر، مدیرعامل این شرکت میگوید: ما با استفاده از نانوذرات، موفق به ساخت نمایشگری شدیم که قطر داخلی آن دو میلیمتر است. این ساختار اورتان تنگستن میتواند گرم شود و دید واضحی در پرتونگاری اشعه ایکس ایجاد کند. در ادوات فعلی از باندهای فلزی مشبک استفاده میشود. این باندهای پلیمری جدید میتوانند روشی ارزانتر و ایمنتر برای این کار باشند. این محصول را میتوان با قطر داخلی 0.004 اینچ و ضخامت دیواره 0.001 اینچ تولید کرد.
محققان یکی از شرکتهای فعال در حوزه ساخت ادوات و مواد مورد استفاده در پرتونگاری اشعه ایکس موفق به ساخت محصول جدیدی برای افزایش دید در ادوات آندوسکوپی مبتنی بر پرتونگاری اشعه ایکس شدند. از محصول جدید شرکت Radiopaque Solutions که در آن از نانوذرات استفاده شده است، در دستگاههای آندوسکوپی برای مشاهده بدن استفاده میشود. این محصول میتواند میزان دوز تابشی را کاهش داده، در نتیجه اثرات جانبی این روش را به حداقل برساند. با استفاده از این ابزار جدید، جراحان میتوانند در طول عمل جراحی دید بهتری داشته باشند. این محصول جایگزین باندهای رایج یکبار مصرف فعلی میشود. توماس لانچر، مدیرعامل این شرکت میگوید: ما با استفاده از نانوذرات، موفق به ساخت نمایشگری شدیم که قطر داخلی آن دو میلیمتر است. این ساختار اورتان تنگستن میتواند گرم شود و دید واضحی در پرتونگاری اشعه ایکس ایجاد کند. در ادوات فعلی از باندهای فلزی مشبک استفاده میشود. این باندهای پلیمری جدید میتوانند روشی ارزانتر و ایمنتر برای این کار باشند. این محصول را میتوان با قطر داخلی 0.004 اینچ و ضخامت دیواره 0.001 اینچ تولید کرد. 

 پژوهشگران دانشگاه ایالتی کارولینای شمالی با قرار دادن نانوالیاف کربنی سوزنی شکل بر روی سطح غشای انعطافپذیر سیلیکونی، موفق به تولید ساختاری انعطافپذیر برای رهاسازی دارو شدند.
پژوهشگران دانشگاه ایالتی کارولینای شمالی با قرار دادن نانوالیاف کربنی سوزنی شکل بر روی سطح غشای انعطافپذیر سیلیکونی، موفق به تولید ساختاری انعطافپذیر برای رهاسازی دارو شدند. محققان دانشکده پزشکی دانشگاه آلبرت انیشتین و دانشگاه کالیفرنیا ترکیب جدیدی از نانوذرات با استفاده از چیتوسان (پلیساکاریدی که از پوسته سختپوستانی مانند خرچنگ و میگو گرفته میشود) ساختهاند که میتوان از آن برای درمان بیماریهای التهابی صورت مانند آکنه (جوش غرور جوانی) استفاده کرد. این نانوذرات نه تنها برای از بین بردن پروپیونیباکتریومِ آکنه (باکتری تشدیدکننده آکنه) موثر است، بلکه از آسیبرسانی التهاب ناشی از آکنه که منجر به زخم بزرگ و دردناک میشود، نیز جلوگیری میکند.
محققان دانشکده پزشکی دانشگاه آلبرت انیشتین و دانشگاه کالیفرنیا ترکیب جدیدی از نانوذرات با استفاده از چیتوسان (پلیساکاریدی که از پوسته سختپوستانی مانند خرچنگ و میگو گرفته میشود) ساختهاند که میتوان از آن برای درمان بیماریهای التهابی صورت مانند آکنه (جوش غرور جوانی) استفاده کرد. این نانوذرات نه تنها برای از بین بردن پروپیونیباکتریومِ آکنه (باکتری تشدیدکننده آکنه) موثر است، بلکه از آسیبرسانی التهاب ناشی از آکنه که منجر به زخم بزرگ و دردناک میشود، نیز جلوگیری میکند.  پروژه کیک استارتر میتواند با استفاده از نانوذرات، تمامی دستکشها را به دستکشهای با قابلیت حس لامسه تبدیل کند. نانولولههای پلی آمیدهای مایع رسانا میتوانند دستکش معمولی را به صفحه نمایش لمسی تبدیل کنند. استفاده از نانولولهها در این مورد تقلید حس لامسه پوست انسان و طراحی آن کاربردی است. طراحی هر کاربرد آن چند هفته تا چند ماه به طول میانجامد که بستگی به نوع عملکرد انتخابی افراد دارد. اگر این دستکش را به طور خاموش بپوشید به سادگی قابل اجرا مجدد خواهد بود. این دستکش به طور مساوی از نانوذرات تشکیل شده و هر ذره به دقت ساخته شده است و با یکدیگر در ارتباط هستند. این شبکه ارتباطی حتی تحت شرایط سخت مانند خم شدن ثابت، سایش، چین وچروک و حتی عناصر طبیعی به همان شکل باقی میماند. نانولولههای متشکل از نانوذرات رسانا اجازه میدهد تا نانوذرات به طور زنجیرهای حتی تحت محرکهای تنش زای فیزیکی در کنار هم باقی بمانند و پلی بین انگشت شما و صفحه لمسی دستگاه ایجاد کند.
پروژه کیک استارتر میتواند با استفاده از نانوذرات، تمامی دستکشها را به دستکشهای با قابلیت حس لامسه تبدیل کند. نانولولههای پلی آمیدهای مایع رسانا میتوانند دستکش معمولی را به صفحه نمایش لمسی تبدیل کنند. استفاده از نانولولهها در این مورد تقلید حس لامسه پوست انسان و طراحی آن کاربردی است. طراحی هر کاربرد آن چند هفته تا چند ماه به طول میانجامد که بستگی به نوع عملکرد انتخابی افراد دارد. اگر این دستکش را به طور خاموش بپوشید به سادگی قابل اجرا مجدد خواهد بود. این دستکش به طور مساوی از نانوذرات تشکیل شده و هر ذره به دقت ساخته شده است و با یکدیگر در ارتباط هستند. این شبکه ارتباطی حتی تحت شرایط سخت مانند خم شدن ثابت، سایش، چین وچروک و حتی عناصر طبیعی به همان شکل باقی میماند. نانولولههای متشکل از نانوذرات رسانا اجازه میدهد تا نانوذرات به طور زنجیرهای حتی تحت محرکهای تنش زای فیزیکی در کنار هم باقی بمانند و پلی بین انگشت شما و صفحه لمسی دستگاه ایجاد کند.  محققان مدرسه پزشکی Icahn منهتن آمریکا با استفاده از فناوری نانو به روشی دست یافتند که میزان سکته مغزی و قلبی را کاهش می دهد. 30 درصد از حملات قلبی به این دلیل اتفاق می افتد که قلب قادر به کنترل التهاب داخل عروق نیست، این فرآیند منجر به لخته شدن خون و پارگی عروق می شود و در نهایت سکته قلبی یا مغزی اتفاق می افتد.
محققان مدرسه پزشکی Icahn منهتن آمریکا با استفاده از فناوری نانو به روشی دست یافتند که میزان سکته مغزی و قلبی را کاهش می دهد. 30 درصد از حملات قلبی به این دلیل اتفاق می افتد که قلب قادر به کنترل التهاب داخل عروق نیست، این فرآیند منجر به لخته شدن خون و پارگی عروق می شود و در نهایت سکته قلبی یا مغزی اتفاق می افتد. یک روش واکسینه جدید با استفاده از نانوذرات، میتواند کلیدی برای مقابله با ویروسهای دستگاه عصبی باشد که یکی از متداولترین بیماریهایی است که از طریق خوردن غذا وارد معده میشود. محققان استرالیایی با کاربرد نانوذرات از طریق واکسنها، آنتیژنهای پپتیدی را برای رشد بیشتر به بدن وارد کردهاند. آنها در این تحقیق آنتیژنهای رترو ویروس را به درون ذرات P وارد کردهاند تا در برابر این ویروس مانند نوروویروسها در موش ایمنی ایجاد کنند.
یک روش واکسینه جدید با استفاده از نانوذرات، میتواند کلیدی برای مقابله با ویروسهای دستگاه عصبی باشد که یکی از متداولترین بیماریهایی است که از طریق خوردن غذا وارد معده میشود. محققان استرالیایی با کاربرد نانوذرات از طریق واکسنها، آنتیژنهای پپتیدی را برای رشد بیشتر به بدن وارد کردهاند. آنها در این تحقیق آنتیژنهای رترو ویروس را به درون ذرات P وارد کردهاند تا در برابر این ویروس مانند نوروویروسها در موش ایمنی ایجاد کنند.  دانشمندان آمریکایی در روش جدید خود، نواحی خاص سلولهای سرطانی را با داروهای مختلف و به طور همزمان هدف قرار دادهاند. این محققان شیوهای را برای تولید نانوذراتی ارائه دادهاند که دو داروی قاتل سرطان را به درون بدن حمل کرده و این داروها را به بخشهای مختلف سلولهای سرطانی تحویل میدهند. محققان دانشگاه ایالتی کارولینای شمالی و دانشگاه کارولینای شمالی در چاپلهیل، این روش را طراحی کردهاند. دکتر ژن گو، نویسنده ارشد این مقاله گفت: با آزمایش بر روی موشها، روش ما در مقایسه با شیوههای درمانی عادی منجر به پیشرفت مهمی در کاهش تومور سرطان پستان شد.
دانشمندان آمریکایی در روش جدید خود، نواحی خاص سلولهای سرطانی را با داروهای مختلف و به طور همزمان هدف قرار دادهاند. این محققان شیوهای را برای تولید نانوذراتی ارائه دادهاند که دو داروی قاتل سرطان را به درون بدن حمل کرده و این داروها را به بخشهای مختلف سلولهای سرطانی تحویل میدهند. محققان دانشگاه ایالتی کارولینای شمالی و دانشگاه کارولینای شمالی در چاپلهیل، این روش را طراحی کردهاند. دکتر ژن گو، نویسنده ارشد این مقاله گفت: با آزمایش بر روی موشها، روش ما در مقایسه با شیوههای درمانی عادی منجر به پیشرفت مهمی در کاهش تومور سرطان پستان شد.  دانشمندان دانشگاه ملی سنگاپور (NUS) و دانشگاه کالیفرنیا با ترکیب داروهای متداول مربوط به لوسمی با نانوالماسها و انتقال داروها به درون سلولهای لوسمی به درمان این نوع سرطان پرداختند. این کشف جدید که برای اولین بار گزارش شده است، میتواند درمانی برای لوسمی (سرطان خون) باشد. زمانی که بیماران در معرض شیمی درمانی قرار میگیرند، سلولهای سرطانی راه بهتری را برای دریافت دارو پیش رو دارند.
دانشمندان دانشگاه ملی سنگاپور (NUS) و دانشگاه کالیفرنیا با ترکیب داروهای متداول مربوط به لوسمی با نانوالماسها و انتقال داروها به درون سلولهای لوسمی به درمان این نوع سرطان پرداختند. این کشف جدید که برای اولین بار گزارش شده است، میتواند درمانی برای لوسمی (سرطان خون) باشد. زمانی که بیماران در معرض شیمی درمانی قرار میگیرند، سلولهای سرطانی راه بهتری را برای دریافت دارو پیش رو دارند.  محققان دانشگاه کالیفرنیا روش دارورسانی جدیدی را ارائه کردند که میتوان با استفاده از آن سلولهای سرطان پانکراس را از بین برد. سرطان پانکراس یک بیماری کشنده بود که تا رسیدن به مراحل پیشرفته بیماری امکان شناسایی آن وجود نداشت. روشهای درمان این بیماری بسیار محدود و نرخ موفقیت آنها نیز بسیار اندک است. برای این که بتوان روشهای جدیدی را برای درمان این بیماری پیدا کرد، باید بتوان ابتدا آن را شناسایی کرد، در حالی که شناسایی این بیماری چند سال پس از آغاز آن قابل انجام است.
محققان دانشگاه کالیفرنیا روش دارورسانی جدیدی را ارائه کردند که میتوان با استفاده از آن سلولهای سرطان پانکراس را از بین برد. سرطان پانکراس یک بیماری کشنده بود که تا رسیدن به مراحل پیشرفته بیماری امکان شناسایی آن وجود نداشت. روشهای درمان این بیماری بسیار محدود و نرخ موفقیت آنها نیز بسیار اندک است. برای این که بتوان روشهای جدیدی را برای درمان این بیماری پیدا کرد، باید بتوان ابتدا آن را شناسایی کرد، در حالی که شناسایی این بیماری چند سال پس از آغاز آن قابل انجام است.