ژندرمانی بیماریهای ریوی با نانوذرات پلیمری
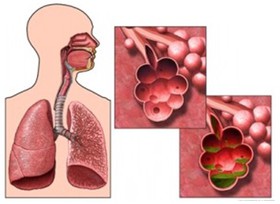 محققان با استفاده از نانوذرات زیستتخریب پذیر موفق به ارائه روش درمانی جدیدی برای ژندرمانی شدند که امکان درمان بیماریهای ژنتیکی ریوی را فراهم میکند. اخیرا مقالهای توسط محققان دانشگاه جانهاپکینز با عنوان Highly compacted biodegradable DNA nanoparticles capable of overcoming the mucus barrier for inhaled lung gene therapy در نشریه Proceedings of the National Academy of Sciences (PNAS) منتشر شده که در آن از نانوساختارهای DNA برای درمان بیماریهای ریه استفاده شده است.
محققان با استفاده از نانوذرات زیستتخریب پذیر موفق به ارائه روش درمانی جدیدی برای ژندرمانی شدند که امکان درمان بیماریهای ژنتیکی ریوی را فراهم میکند. اخیرا مقالهای توسط محققان دانشگاه جانهاپکینز با عنوان Highly compacted biodegradable DNA nanoparticles capable of overcoming the mucus barrier for inhaled lung gene therapy در نشریه Proceedings of the National Academy of Sciences (PNAS) منتشر شده که در آن از نانوساختارهای DNA برای درمان بیماریهای ریه استفاده شده است.
نانوذرات ابزار مناسبی برای ژندرمانی هستند به طوری که میتوان ناهنجاریهای مختلف را با استفاده از این نانوذرات رفع کرد. برای درمان مشکلات ریوی، استفاده از نانوذرات چالشبرانگیز است زیرا سد زیستی در مسیر رهاسازی ژندرمانی وجود دارد. وجود لایهای مخاطی در سراسر سیستم تنفسی عامل محافظت از اندامهای تنفسی در برابر عفونت و عوامل میکروبی خارجی است. همین سیستم مخاط مانع اثربخشی روشهای درمان تنفسی شده و اجازه ورود دارو به این سیستم را نمیدهد.
پژوهشگران از نانوذرات حاوی DNA برای غلبه بر این سد استفاده کردند. آنها از نانوذرات پلیمری زیستسازگار موسوم به PBAEs که دارای روکشی از جنس پلیاتیلن گلیکول است استفاده کردند. این نانوذرات توانستند درون مخاط موجود در سیستم تنفسی نفوذ کنند. این گروه تحقیقاتی این نانوذرات را روی موشهای آزمایشگاهی استفاده کردند و دریافتند بیان ژن در مقادیر بسیار بالایی در این حیوانات انجام شد. نتایج آزمایشها نشان میدهد که این نانوذرات هیچ اثر سمی روی بدن نداشته و به دلیل زیستتخریبپذیر بودن آن کاملاً از بدن دفع شده و درون بدن جمع نمیشوند.
این یافتههای جدید اهمیت زیادی برای درمان بیماری سیستیک فیبروسیس دارد. این بیماری نوعی بیماری ژنتیکی خطرناک است که در آن مخاط بیماری بسیار ضخیم و چسبنده است که مشکلات تنفسی جدی به همراه دارد.
این گروه تحقیقاتی نشان دادند که رهاسازی ژن نرمال با استفاده از نانوذرات حاوی DNA میتواند پروتئینهای ویژهای را در بیمار ایجاد کند که به مدت طولانی در بدن بیمار باقی میماند. محققان معتقدند که این روش میتواند برای درمان بیماریهای مختلفی در انسان به کار رود. برای مثال، این روش برای درمان بیماریهای ژنتیکی ریوی که بسیار خطرناک هستند مناسب است.
 محققان دانشگاه استنفورد روش جدید ژن درمانی را توسعه دادهاند که سلولهای کلیدی سیستم ایمنی بدن را در مقابل حملات ویروس
محققان دانشگاه استنفورد روش جدید ژن درمانی را توسعه دادهاند که سلولهای کلیدی سیستم ایمنی بدن را در مقابل حملات ویروس محققان دانشگاه كرنل موفق به ارائه رويكرد ژندرماني با هدف خنثيسازي اثرات نيكوتين در موشها شدند. اين گروه از ژندرماني جهت وارد كردن نوعي آنتيبادي به بدن استفاده كردند. اين آنتيبادي به ماده شيميايي نيكوتين ميچسبد و از رسيدن آن به مغز جلوگيري ميكند. در اين تحقيق آنتيبادي ضدنيكوتين در موشها با استفاده از ويروس adeno-assocated virus بيان شد. اين ويروس يكي از حاملان مورد استفاده در ژندرماني است كه براي حمل ژنهاي جديد دربدن بيماران به كار ميرود. اين آنتيبادي در ادامه به مولوكولهاي نيكوتين موجود در جريان خون موشها چسبيده و مانع رسيدن آنها به بافتهاي سيستم عصبي ميشود. در نتيجه اين فرايند اين حيوانات در مقابل اثرات ماده شيميايي مزبور ايمن شدند و هيچ گونه تغييري در عملكرد قلب، فشار خون يا فعاليت آنها كه اغلب در اثر استفاده از دوز نيكوتين ديده ميشود، گزارش نشد.
محققان دانشگاه كرنل موفق به ارائه رويكرد ژندرماني با هدف خنثيسازي اثرات نيكوتين در موشها شدند. اين گروه از ژندرماني جهت وارد كردن نوعي آنتيبادي به بدن استفاده كردند. اين آنتيبادي به ماده شيميايي نيكوتين ميچسبد و از رسيدن آن به مغز جلوگيري ميكند. در اين تحقيق آنتيبادي ضدنيكوتين در موشها با استفاده از ويروس adeno-assocated virus بيان شد. اين ويروس يكي از حاملان مورد استفاده در ژندرماني است كه براي حمل ژنهاي جديد دربدن بيماران به كار ميرود. اين آنتيبادي در ادامه به مولوكولهاي نيكوتين موجود در جريان خون موشها چسبيده و مانع رسيدن آنها به بافتهاي سيستم عصبي ميشود. در نتيجه اين فرايند اين حيوانات در مقابل اثرات ماده شيميايي مزبور ايمن شدند و هيچ گونه تغييري در عملكرد قلب، فشار خون يا فعاليت آنها كه اغلب در اثر استفاده از دوز نيكوتين ديده ميشود، گزارش نشد.