تولید آنتیبیوتیک از جلبک دریایی

محققان انگلیسی برآنند تا از خواص ضد میکروبی جلبکهای سواحل این کشور برای پرورش نسل جدیدی از آنتیبیوتیکها به منظور مبارزه با تهدیدات ناشی از ابرمیکروبهای مقاوم استفاده کنند. با افزایش تعداد باکتریهای مقاوم به چند دارو،موسوم به ابرمیکروبها، نیاز مبرمی به داروهای جدید است که بتوانند در صورت تاثیر نداشتن داروهای دیگر،عفونتها را کنترل کنند. محیط زیست میتواند منبعی غنی از آنتی بیوتیکها باشد.
تیم تحقیقاتی دانشگاه اکستر به دنبال پردهبرداری از خواصی هستند که میتوانند بنیانی را برای نسل جدید آنتیبیوتیکهایی تشکیل دهند که عفونت ناشی از ابرمیکروبهایی مانند استافیلوکوک اورئوس مقاوم به متیسیلین (MRSA) را کنترل میکنند. مایکل ووس، رهبر این تحقیق اظهار کرد: آزمایشهای نخستین ما تایید کرده است که جلبکها دارای خواص گوناگون ضدمیکروبی منظمی هستند. به طرز هیجانانگیزی مقداری از این عصارهها در برابر بعضی از باکتریهای مقاوم و مشکلزا مؤثر هستند و ما امیدواریم که تلاش ما بتواند به کشف داروهای جدیدی که هم تاثیر سریعتری دارند و هم ارزانتر هستند، کمک کند.
منطقه ساحلی کورنوال در جنوب غربی بریتانیا بخاطر فراوانی خطوط ساحلی و گونه های جلبکهای دریایی، محل تمام عیاری برای این نوع تحقیقات به شمار میرود. ووس میگوید: برای پیشبرد بیشتر این نظریه، تیم تحقیقاتی یک پروژه تحقیقاتی اختصاصی را تشکیل خواهند داد که به طور قطع بتواند روشنگر عوامل بالقوهای که آنها مد نظر داشتهاند، باشد. مقاومت آنتیبیوتیکها یک مشکل جدی و رو به رشد جهانی است. گزارش سابق سازمان جهانی بهداشت نشان داده بود که این مسئله "یک تهدید عمده برای سلامت عمومی" است.
 دانشمندان دانشگاه کارولینای شمالی و دانشگاه سندیگو نشان دادهاند، مصرف نوعی آنتیبیوتیک منجر به ظهور گونهای باکتری جدید میشود. این کشف میتواند درک انسان از این موضوع را تغییر دهد که چرا باکتریها، آنتیبیوتیک تولید میکنند. دانشمندان مدتها بر این باور بودهاند باکتریها برای کشتن باکتریهای دیگر، آنتیبیوتیک تولید میکنند، با این حال، محققان در مطالعه جدید نشان دادهاند، باکتریها احتمالا به منظور تولید بیوفیلمها و نه فقط کشتن باکتریهای دیگر، این ماده را میسازند.
دانشمندان دانشگاه کارولینای شمالی و دانشگاه سندیگو نشان دادهاند، مصرف نوعی آنتیبیوتیک منجر به ظهور گونهای باکتری جدید میشود. این کشف میتواند درک انسان از این موضوع را تغییر دهد که چرا باکتریها، آنتیبیوتیک تولید میکنند. دانشمندان مدتها بر این باور بودهاند باکتریها برای کشتن باکتریهای دیگر، آنتیبیوتیک تولید میکنند، با این حال، محققان در مطالعه جدید نشان دادهاند، باکتریها احتمالا به منظور تولید بیوفیلمها و نه فقط کشتن باکتریهای دیگر، این ماده را میسازند. 
 محققان انگلیسی در تحقیقات جدید خود دریافتهاند که چگونه برخی سلولهای باکتریایی از حمله آنتیبیوتیکی نجات پیدا میکنند. سلولهای Persister انواع خفتهای از سلولهای معمولی هستند که بصورت تصادفی در جمعیتهای میکروبی شکل گرفته و از مقاومت بالایی نسبت به آنتیبیوتیک برخوردار هستند. محققان مرکز باکتریشناسی مولکولی و عفونت در کالج سلطنتی لندن در تحقیقات جدید خود دریافتهاند، سلولهای باکتریایی با ورود به مرحله توقف تکثیر، به سلولهای Persister تبدیل شده و در برابر آنتیبیوتیک مقاوم میشوند.
محققان انگلیسی در تحقیقات جدید خود دریافتهاند که چگونه برخی سلولهای باکتریایی از حمله آنتیبیوتیکی نجات پیدا میکنند. سلولهای Persister انواع خفتهای از سلولهای معمولی هستند که بصورت تصادفی در جمعیتهای میکروبی شکل گرفته و از مقاومت بالایی نسبت به آنتیبیوتیک برخوردار هستند. محققان مرکز باکتریشناسی مولکولی و عفونت در کالج سلطنتی لندن در تحقیقات جدید خود دریافتهاند، سلولهای باکتریایی با ورود به مرحله توقف تکثیر، به سلولهای Persister تبدیل شده و در برابر آنتیبیوتیک مقاوم میشوند.  دانشمندان یک آنتیبیوتیک جدید و نامتعارف را در نوعی میکروب دریایی شناسایی کردهاند که میتوان آن را برای درمان نوعی میکروب خطرناک و مقاوم به درمان بیمارستانی و سیاه زخم به کار برد. این آنتی بیوتیک که به آن نام «آنترامایسین» داده اند، میتواند اساس تولید خانواده تازهای از آنتیبیوتیکها قرار بگیرد.
دانشمندان یک آنتیبیوتیک جدید و نامتعارف را در نوعی میکروب دریایی شناسایی کردهاند که میتوان آن را برای درمان نوعی میکروب خطرناک و مقاوم به درمان بیمارستانی و سیاه زخم به کار برد. این آنتی بیوتیک که به آن نام «آنترامایسین» داده اند، میتواند اساس تولید خانواده تازهای از آنتیبیوتیکها قرار بگیرد.  مطالعات جدید نشان می دهد، آنتی بیوتیک تولید شده از عرق بدن می تواند ابر باکتریهای خطرناک بیمارستانی و سویههای مرگبار توبرکولین را از بین ببرد.
مطالعات جدید نشان می دهد، آنتی بیوتیک تولید شده از عرق بدن می تواند ابر باکتریهای خطرناک بیمارستانی و سویههای مرگبار توبرکولین را از بین ببرد.  مطالعات صورت گرفته توسط محققان چینی نشان می دهد، خرس های پاندا قادر به تولید آنتی بیوتیک بسیار قوی در خون خود هستند که می تواند بعنوان یک منبع ارزشمند برای تولید داروهای جدید و موثر مورد استفاده قرار بگیرد. محققان دانشگاه کشاورزی نانجینگ با آنالیز DNA خرس های پاندا، ترکیبی موسوم به cathelicidin-AM را در خون این حیوانات شناسایی کرده اند. «شیوون یان» سرپرست تیم تحقیقاتی تأکید می کند: موفق به کشف توانایی بالقوه ضد میکروبی در سیستم ایمنی بدن خرس پاندا در برابر طیف وسیعی از میکروارگانیسم ها شامل باکتری و قارچ شدیم؛ این ترکیب قادر به از بین بردن گونه های مقاوم در برابر دارو بوده و می تواند منجر به توسعه روش های جدید درمان در برابر ابر باکتری ها و سایر بیماری ها شود.
مطالعات صورت گرفته توسط محققان چینی نشان می دهد، خرس های پاندا قادر به تولید آنتی بیوتیک بسیار قوی در خون خود هستند که می تواند بعنوان یک منبع ارزشمند برای تولید داروهای جدید و موثر مورد استفاده قرار بگیرد. محققان دانشگاه کشاورزی نانجینگ با آنالیز DNA خرس های پاندا، ترکیبی موسوم به cathelicidin-AM را در خون این حیوانات شناسایی کرده اند. «شیوون یان» سرپرست تیم تحقیقاتی تأکید می کند: موفق به کشف توانایی بالقوه ضد میکروبی در سیستم ایمنی بدن خرس پاندا در برابر طیف وسیعی از میکروارگانیسم ها شامل باکتری و قارچ شدیم؛ این ترکیب قادر به از بین بردن گونه های مقاوم در برابر دارو بوده و می تواند منجر به توسعه روش های جدید درمان در برابر ابر باکتری ها و سایر بیماری ها شود.  محققان دانشگاه مسکو به منبع بالقوهای از آنتی بیوتیک در پوست قورباغه قهوهای روسیه دست یافتند که میتواند منجر به تولید نسل جدید داروی آنتی بیوتیک شود. قرار دادن قورباغه درون سطل شیر یکی از روش های سنتی و قدیمی در روسیه برای پیشگیری از ترش شدن این محصول محسوب می شود. محققان شیمی آلی دانشگاه مسکو به سرپرستی «ای. لبدوف» در تحقیقات خود با الهام از این سنت قدیمی، موفق به شناسایی تعدادی از ترکیبات آنتی بیوتیک جدید در پوست قورباغه قهوه ای روسیه شده اند. به گفته محققان، دوزیستان برای دفاع در برابر باکتری ها و میکروارگانیسم ها در محیط مرطوب زندگی خود، مواد آنتی بیوتیک موسوم به «پپتید» از طریق پوست ترشح می کنند.
محققان دانشگاه مسکو به منبع بالقوهای از آنتی بیوتیک در پوست قورباغه قهوهای روسیه دست یافتند که میتواند منجر به تولید نسل جدید داروی آنتی بیوتیک شود. قرار دادن قورباغه درون سطل شیر یکی از روش های سنتی و قدیمی در روسیه برای پیشگیری از ترش شدن این محصول محسوب می شود. محققان شیمی آلی دانشگاه مسکو به سرپرستی «ای. لبدوف» در تحقیقات خود با الهام از این سنت قدیمی، موفق به شناسایی تعدادی از ترکیبات آنتی بیوتیک جدید در پوست قورباغه قهوه ای روسیه شده اند. به گفته محققان، دوزیستان برای دفاع در برابر باکتری ها و میکروارگانیسم ها در محیط مرطوب زندگی خود، مواد آنتی بیوتیک موسوم به «پپتید» از طریق پوست ترشح می کنند.  مهندسان دانشگاه براون موفق به كنترل باكتري استافیلوکوکوس اورئوس با استفاده از نانوذرات سلنيوم شدند. سلنیوم یک عنصر ارزان است و بطور طبیعی به بدن تعلق دارد. اگرچه مشخص شده است که این عنصر به باکتریها حمله میکند، اما هنوز سلنیوم بعنوان روکش آنتیبیوتیک روی مواد افزاره پزشکی امتحان نشده است. مهندسان دانشگاه براون در یک مطالعه جدید گزارش کردهاند هنگامی که آنها از نانوذرات سلنیومی برای روکش پلیکربنات که ماده سازنده لولههای جراحی بولی و ریوی است، استفاده میکنند، کاهش زیادی در جمعیت باکتری استافیلوکوکوس آریوس کشت شده تا مقدار 90 درصد مشاهده میشود.
مهندسان دانشگاه براون موفق به كنترل باكتري استافیلوکوکوس اورئوس با استفاده از نانوذرات سلنيوم شدند. سلنیوم یک عنصر ارزان است و بطور طبیعی به بدن تعلق دارد. اگرچه مشخص شده است که این عنصر به باکتریها حمله میکند، اما هنوز سلنیوم بعنوان روکش آنتیبیوتیک روی مواد افزاره پزشکی امتحان نشده است. مهندسان دانشگاه براون در یک مطالعه جدید گزارش کردهاند هنگامی که آنها از نانوذرات سلنیومی برای روکش پلیکربنات که ماده سازنده لولههای جراحی بولی و ریوی است، استفاده میکنند، کاهش زیادی در جمعیت باکتری استافیلوکوکوس آریوس کشت شده تا مقدار 90 درصد مشاهده میشود. 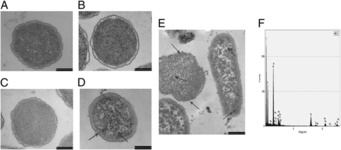 مطالعات محققان چيني بر روي تاثير نانومواد بر باکتريها نشان ميدهد نانومواد ميتواند مقاومت باکتريها را در برابر آنتي بيوتيک افزايش دهد. نبرد ميان توليد آنتيبيوتيکها و باکتريها همچنان ادامه دارد. باکتريها به سرعت ميتوانند تغيير کرده و از نظر ژنتيکي خود را با داروهاي آنتيبيوتيک وفق دهند. اين کار از طريق انتقال ژن در هم آميختگي انجام ميشود. اين روند ميتواند در سطح جهاني اتفاق افتاده و در نهايت موجب پديدار شدن گونهاي از باکتريها به نام ابرباکتري شود که نسبت به بسياري از داروها از ايمني برخوردار هستند.
مطالعات محققان چيني بر روي تاثير نانومواد بر باکتريها نشان ميدهد نانومواد ميتواند مقاومت باکتريها را در برابر آنتي بيوتيک افزايش دهد. نبرد ميان توليد آنتيبيوتيکها و باکتريها همچنان ادامه دارد. باکتريها به سرعت ميتوانند تغيير کرده و از نظر ژنتيکي خود را با داروهاي آنتيبيوتيک وفق دهند. اين کار از طريق انتقال ژن در هم آميختگي انجام ميشود. اين روند ميتواند در سطح جهاني اتفاق افتاده و در نهايت موجب پديدار شدن گونهاي از باکتريها به نام ابرباکتري شود که نسبت به بسياري از داروها از ايمني برخوردار هستند.