..:::: فناوری جدید دانشمندان برای تولید داروی ایدز و سرطان ::::..
 یکی از شرکتهای داروسازی تولیدکننده داروهای مبتنی بر فناوری نانو، موفق به ارائه روشی برای کپسوله کردن تتراهیدروکانابینول که از گیاه شاهدانه گرفته میشود، شده است. «تریور کاسترو» از محققان و مخترعین این پتنت میگوید: این فناوری جدید میتواند برای تولید APH-0812 مورد استفاده قرار گیرد؛ این ترکیب میتواند در درمان بیماری ایدز و برخی سرطانها مفید باشد. همچنین با این فناوری میتوان APH-1305 نیز تولید کرد که به عنوان ماده شیمیایی در درمان MS و برخی ناهنجاریها مورد استفاده قرار میگیرد. فرمولاسیون مبتنی بر فناوری نانو که در ترکیب Δ9-THC مورد استفاده قرار گرفت، برای برخی بیماریهای مزمن نظیر چاقی، ترک سیگار و اسکیزوفرنی نیز میتواند مورد استفاده قرار گیرد.
یکی از شرکتهای داروسازی تولیدکننده داروهای مبتنی بر فناوری نانو، موفق به ارائه روشی برای کپسوله کردن تتراهیدروکانابینول که از گیاه شاهدانه گرفته میشود، شده است. «تریور کاسترو» از محققان و مخترعین این پتنت میگوید: این فناوری جدید میتواند برای تولید APH-0812 مورد استفاده قرار گیرد؛ این ترکیب میتواند در درمان بیماری ایدز و برخی سرطانها مفید باشد. همچنین با این فناوری میتوان APH-1305 نیز تولید کرد که به عنوان ماده شیمیایی در درمان MS و برخی ناهنجاریها مورد استفاده قرار میگیرد. فرمولاسیون مبتنی بر فناوری نانو که در ترکیب Δ9-THC مورد استفاده قرار گرفت، برای برخی بیماریهای مزمن نظیر چاقی، ترک سیگار و اسکیزوفرنی نیز میتواند مورد استفاده قرار گیرد.
این شرکت با این فناوری، داروی حاوی Δ9-THC را با نام تجاری Dronabinol® تولید و به بازار عرضه کرده است؛ این داروی خوراکی مبتنی بر نانوذرات پلیمری قابل تجزیه است. این شرکت همچنین ترکیب Δ9-THC را داخل روغن دانه کنجد حل کرده و داروی خوراکی دیگری موسوم به Marinol® را به بازار عرضه کرده است. در این فرمولاسیون جدید، ترکیب Δ9-THC به آهستگی رهاسازی میشود.
با این فناوری جدید، Δ9-THC را میتوان با خلوص مناسب بیش از 99 درصد جهت استفاده در داروسازی تولید کرد. در این پتنت، محققان نشان دادند که چگونه میتوان از پلیمرهای قابل تجزیه برای کپسوله کردن Δ9-THC استفاده کرد. کپسوله کردن این ترکیب درون پلیمر موجب محافظت از آن در معده و روده میشود. با این فرمولاسیون رهایش Δ9-THC به کندی صورت میگیرد و با این کار مقدار این ماده در جریان خون در حد مشخصی ثابت میماند. شرکت «Aphios» در حوزه درمان بیماریهایی نظیر سرطان، ناهنجاریهای عصبی و بیماریهای عفونی داروهایی را تولید کرده است. بخشی از حمایتهای مالی پروژه اخیر این شرکت، توسط موسسه ملی سرطان امریکا تامین شده است.
 محققان دانشگاه مینهسوتا با استفاده از نانوذرات به عنوان حامل، عوارض ماده شیمیایی TNF-a را که میتواند رگهای خونی اطراف تومور را از بین ببرد، به حداقل رساندهاند. در سالهای اخیر محققان موفق شدند روشی برای از بین بردن رگهای پیرامون تومورها پیدا کنند با این کار میتوان تومورها را از بین برد. برای این کار از مواد شیمیایی مختلف استفاده میشود. یکی از این ترکیبات کاچکسین یا TNF-a است که نتایج بسیار خوبی داده است، مشکل این ماده سمی بودن آن است که میتواند عوارض جانبی داشته باشد. برای کاهش سمیت این ماده میتوان از نانوذرات طلا استفاده کرد. این نانوذرات میتوانند به عنوان حامل این ماده دارو را در محل مورد نظر رهاسازی کنند. این فرآیند فاز اول تست بالینی را پشت سر گذاشته است.
محققان دانشگاه مینهسوتا با استفاده از نانوذرات به عنوان حامل، عوارض ماده شیمیایی TNF-a را که میتواند رگهای خونی اطراف تومور را از بین ببرد، به حداقل رساندهاند. در سالهای اخیر محققان موفق شدند روشی برای از بین بردن رگهای پیرامون تومورها پیدا کنند با این کار میتوان تومورها را از بین برد. برای این کار از مواد شیمیایی مختلف استفاده میشود. یکی از این ترکیبات کاچکسین یا TNF-a است که نتایج بسیار خوبی داده است، مشکل این ماده سمی بودن آن است که میتواند عوارض جانبی داشته باشد. برای کاهش سمیت این ماده میتوان از نانوذرات طلا استفاده کرد. این نانوذرات میتوانند به عنوان حامل این ماده دارو را در محل مورد نظر رهاسازی کنند. این فرآیند فاز اول تست بالینی را پشت سر گذاشته است. 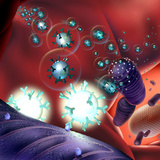 محققان مؤسسه تحقیقات کاربردی پلیمر فرانهوفر آلمان شیوه جدیدی ابداع کردهاند که به نمایش مواد حاوی نانوذرات با قابلیت کشتن انتخابی سلولهای تومور میپردازد. محققان از آبگریزها یا وزیکولهای چربی نامحلول در آب به عنوان حاملهای دارویی کوچک 200 تا 250 نانومتری استفاده کردند. این حاملها از لحاظ زیستی در بدن پس از استقرار قابل تخریب و تجزیه هستند. از پلیمرها برای تثبیت نانوپوشش استفاده میشود که از مولکولهای بسیار خاص و به رسمیت شناخته شده توسط سلولهای تومور برخوردارند. این پوشش نانوذرات که متخصصان آن را ویزکول مینامند، از ساختاری شبیه سلول برخوردارند.
محققان مؤسسه تحقیقات کاربردی پلیمر فرانهوفر آلمان شیوه جدیدی ابداع کردهاند که به نمایش مواد حاوی نانوذرات با قابلیت کشتن انتخابی سلولهای تومور میپردازد. محققان از آبگریزها یا وزیکولهای چربی نامحلول در آب به عنوان حاملهای دارویی کوچک 200 تا 250 نانومتری استفاده کردند. این حاملها از لحاظ زیستی در بدن پس از استقرار قابل تخریب و تجزیه هستند. از پلیمرها برای تثبیت نانوپوشش استفاده میشود که از مولکولهای بسیار خاص و به رسمیت شناخته شده توسط سلولهای تومور برخوردارند. این پوشش نانوذرات که متخصصان آن را ویزکول مینامند، از ساختاری شبیه سلول برخوردارند. 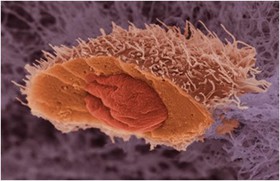 محققان دانشگاه مکگیل کانادا موفق به طراحی نانوقفسهای مبتنی بر رشتههای دیانای شدند که از آن میتوان برای رهایش هوشمند دارو استفاده کرد. در حال حاضر این گروه تحقیقاتی در حال مطالعه اثربخشی این نانوقفسههای مبتنی بر دیانای روی سرطان پروستات در حیوانات هستند تا در صورت موفقیت، تجاریسازی این سیستم دارویی را پیگیری کنند. نتایج این پروژه میتواند منجر به تولید داروهای جدید شود. «هانادی اسلیمان» از محققان این پروژه میگوید: این پروژه برای توسعه سیستمهای رهایش دارویی بسیار مهم است، از سوی دیگر این پروژه از نظر فناوری نانو و زیستشناسی نیز حائز اهمیت است.
محققان دانشگاه مکگیل کانادا موفق به طراحی نانوقفسهای مبتنی بر رشتههای دیانای شدند که از آن میتوان برای رهایش هوشمند دارو استفاده کرد. در حال حاضر این گروه تحقیقاتی در حال مطالعه اثربخشی این نانوقفسههای مبتنی بر دیانای روی سرطان پروستات در حیوانات هستند تا در صورت موفقیت، تجاریسازی این سیستم دارویی را پیگیری کنند. نتایج این پروژه میتواند منجر به تولید داروهای جدید شود. «هانادی اسلیمان» از محققان این پروژه میگوید: این پروژه برای توسعه سیستمهای رهایش دارویی بسیار مهم است، از سوی دیگر این پروژه از نظر فناوری نانو و زیستشناسی نیز حائز اهمیت است. 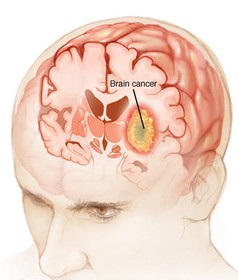 یک تیم تحقیقاتی در مرکز سرطان جانسون موفق به ارائه یک سیستم دارویی شامل نانوذرات الماس شدند که میتواند سلولهای سرطان مغز را از بین ببرد بدون این که به سلولهای سالم اطراف اثری داشته باشد. عوامل شیمیدرمانی نظیر دوکسوروبیسین دارای عوارض جانبی زیادی روی بدن هستند که با سیستم دارویی جدید که در آن از نانوذرات الماس به عنوان حمل کننده داروی شیمیدرمانی برای رهایش مستقیم در تومور مغز استفاده شده، عوارض جانبی دارو کاهش یافته و اثربخشی آن بالا رفته است.
یک تیم تحقیقاتی در مرکز سرطان جانسون موفق به ارائه یک سیستم دارویی شامل نانوذرات الماس شدند که میتواند سلولهای سرطان مغز را از بین ببرد بدون این که به سلولهای سالم اطراف اثری داشته باشد. عوامل شیمیدرمانی نظیر دوکسوروبیسین دارای عوارض جانبی زیادی روی بدن هستند که با سیستم دارویی جدید که در آن از نانوذرات الماس به عنوان حمل کننده داروی شیمیدرمانی برای رهایش مستقیم در تومور مغز استفاده شده، عوارض جانبی دارو کاهش یافته و اثربخشی آن بالا رفته است.  پژوهشگران دانشگاه رایس موفق به ساخت ترکیبی با نام تجاری Bi@US-tubes شدند که از آن میتوان برای افزایش کنتراست سلولهای بنیادی در سیتیاسکن استفاده کرد. بیسموت مادهای است که در تولید برخی داروها از آن استفاده میشود، این ماده کاربردهای پزشکی و آرایشی هم دارد. گروه تحقیقاتی دانشگاه رایس بیسموت را داخل نانولوله کربنی قرار دادند و از آن به عنوان عامل کنتراست دهنده موثر در اسکنرهای سیتی اسکن استفاده کردند. نتایج این پژوهش در نشریه Journal of Materials Chemistry B به چاپ رسیده است.
پژوهشگران دانشگاه رایس موفق به ساخت ترکیبی با نام تجاری Bi@US-tubes شدند که از آن میتوان برای افزایش کنتراست سلولهای بنیادی در سیتیاسکن استفاده کرد. بیسموت مادهای است که در تولید برخی داروها از آن استفاده میشود، این ماده کاربردهای پزشکی و آرایشی هم دارد. گروه تحقیقاتی دانشگاه رایس بیسموت را داخل نانولوله کربنی قرار دادند و از آن به عنوان عامل کنتراست دهنده موثر در اسکنرهای سیتی اسکن استفاده کردند. نتایج این پژوهش در نشریه Journal of Materials Chemistry B به چاپ رسیده است.  شیوه جدید دانشمندان دانشگاه پرینستون و دانشگاه میشیگان از رایانه و نه تیغ جراحی برای جداسازی و شناسایی ژنهای مشتقشده از انواع خاص سلولی بهره میگیرد. درک چگونگی عملکرد ژنها در بافتهای خاص برای مقابله با بیماریهای انسانی از قبیل بیماریهای قلبی، نارسایی کلیه و سرطان حیاتی است. با این حال ایزولهکردن انواع سلولها در این نوع مطالعه برای اکثر بافتها غیرممکن است. این شیوه که "کالبدشکافی نانوسیلیکونی" نام گرفته، مطالعه نظاممند ژنهای دخیل در بیماریها را ممکن میکند.
شیوه جدید دانشمندان دانشگاه پرینستون و دانشگاه میشیگان از رایانه و نه تیغ جراحی برای جداسازی و شناسایی ژنهای مشتقشده از انواع خاص سلولی بهره میگیرد. درک چگونگی عملکرد ژنها در بافتهای خاص برای مقابله با بیماریهای انسانی از قبیل بیماریهای قلبی، نارسایی کلیه و سرطان حیاتی است. با این حال ایزولهکردن انواع سلولها در این نوع مطالعه برای اکثر بافتها غیرممکن است. این شیوه که "کالبدشکافی نانوسیلیکونی" نام گرفته، مطالعه نظاممند ژنهای دخیل در بیماریها را ممکن میکند. 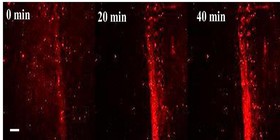 یک گروه تحقیقاتی از دانشگاه بوستون و دانشگاه ایالتی پنسیلوانیا موفق به ابداع روشی شدند که با استفاده از آن میتوان داروی ترمیمکننده را به درون میکروترکهای موجود در استخوان وارد کرد. برای ترمیم استخوان با دارو، ترکیبات دارویی وارد خون میشوند تا به ترکهای استخوان برسند.
یک گروه تحقیقاتی از دانشگاه بوستون و دانشگاه ایالتی پنسیلوانیا موفق به ابداع روشی شدند که با استفاده از آن میتوان داروی ترمیمکننده را به درون میکروترکهای موجود در استخوان وارد کرد. برای ترمیم استخوان با دارو، ترکیبات دارویی وارد خون میشوند تا به ترکهای استخوان برسند.  پژوهشگران موسسه فناوری جورجیا موفق به ساخت اولین حسگر شبیه پوست بدن با حساسیت بالا شدند که در آن از دیودهای نشر نور استفاده شده و قادر است فشار وارده شده را به سیگنال نوری تبدیل کند. پوستهای مصنوعی ساخته شده تاکنون، دارای قدرت تفکیک کمی هستند. اما پوست مصنوعی ساخته شده از نانوسیمهای اکسید روی محققان موسسه جورجیا دارای حساسیت بالایی است و البته عملکرد این دستگاه، مدیون اثر پیزوفتوترونیک است که حساسیت آن از حساسیت پوست بدن بیشتر است. این محصول میتواند برای حوزه ساخت روبات بسیار ایدهآل باشد. همچنین از آن میتوان در تولید نسل جدید پدهای صفحه لمسی، ادوات تصویربرداری زیستی و سیستمهای MEMS استفاده کرد.
پژوهشگران موسسه فناوری جورجیا موفق به ساخت اولین حسگر شبیه پوست بدن با حساسیت بالا شدند که در آن از دیودهای نشر نور استفاده شده و قادر است فشار وارده شده را به سیگنال نوری تبدیل کند. پوستهای مصنوعی ساخته شده تاکنون، دارای قدرت تفکیک کمی هستند. اما پوست مصنوعی ساخته شده از نانوسیمهای اکسید روی محققان موسسه جورجیا دارای حساسیت بالایی است و البته عملکرد این دستگاه، مدیون اثر پیزوفتوترونیک است که حساسیت آن از حساسیت پوست بدن بیشتر است. این محصول میتواند برای حوزه ساخت روبات بسیار ایدهآل باشد. همچنین از آن میتوان در تولید نسل جدید پدهای صفحه لمسی، ادوات تصویربرداری زیستی و سیستمهای MEMS استفاده کرد.  دانشمندان، تار ابریشمی عنکبوت را با نانولوله های کربنی پوشش داده و الیافی ساخته اند که نه تنها بسیار مستحکم است بلکه رسانای برق نیز هست. این نخ جدید سه برابر مستحکم تر از ابریشم تار عنکبوت است که یکی از مستحکم و قوی ترین مواد شناخته شده در طبیعت محسوب می شود. نخستین کاربرد این نخ مستحکم جدید در وسایل پزشکی نانومقیاس اعلام شده است.
دانشمندان، تار ابریشمی عنکبوت را با نانولوله های کربنی پوشش داده و الیافی ساخته اند که نه تنها بسیار مستحکم است بلکه رسانای برق نیز هست. این نخ جدید سه برابر مستحکم تر از ابریشم تار عنکبوت است که یکی از مستحکم و قوی ترین مواد شناخته شده در طبیعت محسوب می شود. نخستین کاربرد این نخ مستحکم جدید در وسایل پزشکی نانومقیاس اعلام شده است. محققان ژاپنی موفق به ساخت مادهای حاوی نانوساختارهای چسبنده شدند که در صورت اعمال در محل خونریزی میتواند خونریزیهای شدید را کنترل کرده و مانع از خونریزی سیاهرگ بزرگ شود. پارهشدن رگها در اثر حادثه، تصادف یا جراحی در صورت شدید بودن میتواند به قیمت جان بیمار تمام شود. این مشکل در مورد سیاهرگ بزرگ بسیار حاد است، زیرا دیوارهای بسیار نازک داشته و حجم بالایی از خون در آن جریان دارد. در صورت آسیب دیدن این سیاهرگ روشهای بسیار ویژهای برای مهار و ممانعت از خونریزی نیاز است.
محققان ژاپنی موفق به ساخت مادهای حاوی نانوساختارهای چسبنده شدند که در صورت اعمال در محل خونریزی میتواند خونریزیهای شدید را کنترل کرده و مانع از خونریزی سیاهرگ بزرگ شود. پارهشدن رگها در اثر حادثه، تصادف یا جراحی در صورت شدید بودن میتواند به قیمت جان بیمار تمام شود. این مشکل در مورد سیاهرگ بزرگ بسیار حاد است، زیرا دیوارهای بسیار نازک داشته و حجم بالایی از خون در آن جریان دارد. در صورت آسیب دیدن این سیاهرگ روشهای بسیار ویژهای برای مهار و ممانعت از خونریزی نیاز است.  یک تیم تحقیقاتی با استفاده از عصاره یک گیاه موفق به تولید نانوذرات طلا با خواص آنتیباکتریال شده است. نانوذرات طلا کاربرد وسیعی در پزشکی دارند، اما تولید آنها بسیار پرهزینه است. پژوهشگران دانشگاه مورداک، روش زیست سازگاری را برای تولید نانوذرات آنتیباکتریال طلا یافتند. از این نانوذرات میتوان در پزشکی استفاده کرد.
یک تیم تحقیقاتی با استفاده از عصاره یک گیاه موفق به تولید نانوذرات طلا با خواص آنتیباکتریال شده است. نانوذرات طلا کاربرد وسیعی در پزشکی دارند، اما تولید آنها بسیار پرهزینه است. پژوهشگران دانشگاه مورداک، روش زیست سازگاری را برای تولید نانوذرات آنتیباکتریال طلا یافتند. از این نانوذرات میتوان در پزشکی استفاده کرد.  محققان با قراردادن آنتیبادیهای ضد سرطان درون یک نانوذره زیستسازگار، نه تنها موفق به از بین بردن تومورها شدند، بلکه احتمال بازگشت سرطان را نیز به حداقل رساندند. هرسپتین و کامپتوتسین دو عامل ضد سرطان بسیار قوی هستند که میتوانند در درمان سرطان بسیار اثربخش باشند. هرسپتین یک آنتیبادی برای هدف قرار دادن فاکتور رشد در سرطان سینه است، بیمارانی که این آنتیبادی را دریافت میکنند، برای مدتی رشد تومور در آنها کند میشود، ولی بعد از مدتی تومور به رشد عادی خود ادامه میدهد که دلیل این امر مقاومت تومور به این آنتیبادی است. برای حل این مشکل یک تیم تحقیقاتی از موسسه فناوری کالیفرنیا به رهبری «مارک دیویس» سیستم جدیدی ارائه کردند که در آن اثربخشی داروی ضد سرطان سینه با استفاده از فناوری نانو بهبود پیدا میکند. این که از نانوذرات برای تولید داروی ضد سرطان استفاده شود چیز جدیدی نیست، آنچه که این گروه برای اولین بار ارائه کردند این است که یک آنتیبادی منفرد به یک نانوذره متصل میشود و هر دوی آنها به عنوان یک داروی ضد سرطان عمل میکنند.
محققان با قراردادن آنتیبادیهای ضد سرطان درون یک نانوذره زیستسازگار، نه تنها موفق به از بین بردن تومورها شدند، بلکه احتمال بازگشت سرطان را نیز به حداقل رساندند. هرسپتین و کامپتوتسین دو عامل ضد سرطان بسیار قوی هستند که میتوانند در درمان سرطان بسیار اثربخش باشند. هرسپتین یک آنتیبادی برای هدف قرار دادن فاکتور رشد در سرطان سینه است، بیمارانی که این آنتیبادی را دریافت میکنند، برای مدتی رشد تومور در آنها کند میشود، ولی بعد از مدتی تومور به رشد عادی خود ادامه میدهد که دلیل این امر مقاومت تومور به این آنتیبادی است. برای حل این مشکل یک تیم تحقیقاتی از موسسه فناوری کالیفرنیا به رهبری «مارک دیویس» سیستم جدیدی ارائه کردند که در آن اثربخشی داروی ضد سرطان سینه با استفاده از فناوری نانو بهبود پیدا میکند. این که از نانوذرات برای تولید داروی ضد سرطان استفاده شود چیز جدیدی نیست، آنچه که این گروه برای اولین بار ارائه کردند این است که یک آنتیبادی منفرد به یک نانوذره متصل میشود و هر دوی آنها به عنوان یک داروی ضد سرطان عمل میکنند. 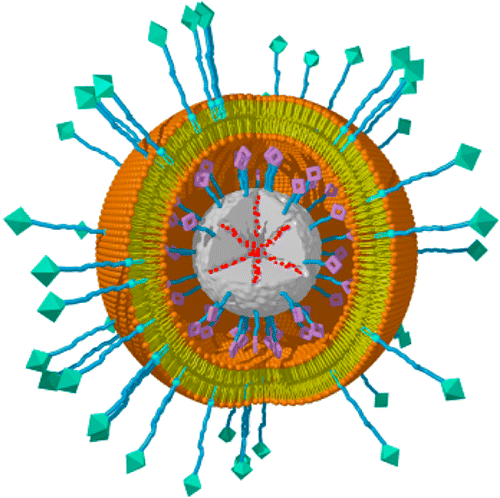 محققان آلمانی روشی برای تولید نانوذرات ایجاد کردهاند که میتواند با تطبیقپذیری بالا برای دارورسانی به سلولهای سرطانی گوناگون مورد استفاده قرار گیرد. این روش جدید امکان ساخت نانوذرات را با طراحیهای ویژه برای کاربردی به خصوص فراهم میکند. این ذرات میتوانند به راحتی با عوامل شیمیایی گوناگون بارگذاری شده و با برچسبگذاری برای یک گونه خاص سلول مورد استفاده قرار گیرند؛ بنابراین این ذرات به سلولهای سرطانی مشخصی چسبیده و دارو را آزاد میکنند. بدین صورت داروی ضدسرطان مستقیما و به طور خاص به سلول سرطانی خواهد رسید.
محققان آلمانی روشی برای تولید نانوذرات ایجاد کردهاند که میتواند با تطبیقپذیری بالا برای دارورسانی به سلولهای سرطانی گوناگون مورد استفاده قرار گیرد. این روش جدید امکان ساخت نانوذرات را با طراحیهای ویژه برای کاربردی به خصوص فراهم میکند. این ذرات میتوانند به راحتی با عوامل شیمیایی گوناگون بارگذاری شده و با برچسبگذاری برای یک گونه خاص سلول مورد استفاده قرار گیرند؛ بنابراین این ذرات به سلولهای سرطانی مشخصی چسبیده و دارو را آزاد میکنند. بدین صورت داروی ضدسرطان مستقیما و به طور خاص به سلول سرطانی خواهد رسید. 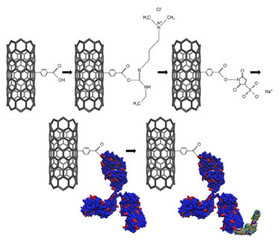 محققان با اتصال آنتیبادی به نانولوله کربنی موفق به ساخت حسگری با حساسیت بالا برای شناسایی نوعی بیماری پوستی حاصل از نیش کنه شدند. این حسگر زیستی قادر به شناسایی آنتیژنهای بیماری «لیم» است. این حسگر قادر است مواد زیستی مربوط به این بیماری را در غلظتهایی کمتر از یک نانوگرم در میلیلیتر شناسایی کند. این رقم بسیار کمتر از پایینترین حد استاندارد تستهای ELISA رایج و آرایه ایمنی وسترن بلات است.
محققان با اتصال آنتیبادی به نانولوله کربنی موفق به ساخت حسگری با حساسیت بالا برای شناسایی نوعی بیماری پوستی حاصل از نیش کنه شدند. این حسگر زیستی قادر به شناسایی آنتیژنهای بیماری «لیم» است. این حسگر قادر است مواد زیستی مربوط به این بیماری را در غلظتهایی کمتر از یک نانوگرم در میلیلیتر شناسایی کند. این رقم بسیار کمتر از پایینترین حد استاندارد تستهای ELISA رایج و آرایه ایمنی وسترن بلات است.  محققان وصلهای مرکب از سلولهای قلبی و نانو الیاف طلا را توسعه داده اند که میتواند به ترمیم بافت آسیبدیده در بیماران دچار سکته قلبی کمک کند. پس از بروز حمله قلبی، بخشی از بافت قلب دچار آسیب جدی شده و این مسأله منجر به تضعیف این عضو میشود. وصلهای که توسط محققان توسعه داده شده است، ترکیبی از سلولهای قلبی و نانو الیاف طلا است که با انجام عمل جراحی بر روی مناطق آسیب دیده قرار داده شده و امکان رشد مجدد بافت قلب را فراهم میکند.
محققان وصلهای مرکب از سلولهای قلبی و نانو الیاف طلا را توسعه داده اند که میتواند به ترمیم بافت آسیبدیده در بیماران دچار سکته قلبی کمک کند. پس از بروز حمله قلبی، بخشی از بافت قلب دچار آسیب جدی شده و این مسأله منجر به تضعیف این عضو میشود. وصلهای که توسط محققان توسعه داده شده است، ترکیبی از سلولهای قلبی و نانو الیاف طلا است که با انجام عمل جراحی بر روی مناطق آسیب دیده قرار داده شده و امکان رشد مجدد بافت قلب را فراهم میکند.  محققان مؤسسه علوم و فناوری پیشرفته کره جنوبی (KAIST) جهت حداکثر کردن پاسخ نوع خاصی از حسگرهای ترکیبات آلی فرار (VOCs)، روی روشی برای اصلاح ساختارهای یکبعدی (نانوالیاف اکسید قلع) تمرکز کردهاند. دوو کیم و همکارانش از مؤسسه علوم و فناوری پیشرفته کره جنوبی (KAIST) جهت حداکثر کردن پاسخ نوع خاصی از حسگرهای ترکیبات آلی فرار (VOCs)، روی روشی برای اصلاح ساختارهای یکبعدی (نانوالیاف اکسید قلع) تمرکز کردهاند. آنها نشان دادهاند که در صورت بهینه کردن مورفولوژی و میکروساختار اکسید قلع، این حسگرهای مقاومت شیمیایی، بعنوان حسگرهای VOCs میتوانند غلظتهای بسیار کمی از استون را شناسایی کنند.
محققان مؤسسه علوم و فناوری پیشرفته کره جنوبی (KAIST) جهت حداکثر کردن پاسخ نوع خاصی از حسگرهای ترکیبات آلی فرار (VOCs)، روی روشی برای اصلاح ساختارهای یکبعدی (نانوالیاف اکسید قلع) تمرکز کردهاند. دوو کیم و همکارانش از مؤسسه علوم و فناوری پیشرفته کره جنوبی (KAIST) جهت حداکثر کردن پاسخ نوع خاصی از حسگرهای ترکیبات آلی فرار (VOCs)، روی روشی برای اصلاح ساختارهای یکبعدی (نانوالیاف اکسید قلع) تمرکز کردهاند. آنها نشان دادهاند که در صورت بهینه کردن مورفولوژی و میکروساختار اکسید قلع، این حسگرهای مقاومت شیمیایی، بعنوان حسگرهای VOCs میتوانند غلظتهای بسیار کمی از استون را شناسایی کنند.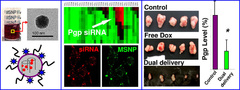 بر اساس آزمایشات جدید محققان دانشگاه کالیفرنیا، نانوذرات متخلخل سیلیکا میتوانند برای غلبه بر مقاومت دارویی در سلولهای سرطانی مورد استفاده قرار گیرند. به گزارش سرویس فناوری ایسنا، منافذ این نانوذرات میتوانند برای جابهجایی داروی ضدسرطان دوکسوروبیسین و نوع خاصی از ریبونوکلئیک اسید (RNA) استفاده شود. در مرحله بعد این دو دارو به طور موثری در نواحی توموری، در موشهایی که سلولهای سرطانی سینه مقاوم در برابر دارو به آنها پیوند زده شده است، آزاد شدند. اکثر روشهای شیمیدرمانی شامل ترکیب چند داروی معالج برای جلوگیری از مقاومت دارویی در بیماران مبتلا به سرطان است. با این وجود، سلولهای سرطانی میتوانند خود را در مقابل بیشتر داروهای مورد استفاده سازگار و مقاوم کنند؛ مسالهای که در نهایت منجر به شکست طرح درمان میشود.
بر اساس آزمایشات جدید محققان دانشگاه کالیفرنیا، نانوذرات متخلخل سیلیکا میتوانند برای غلبه بر مقاومت دارویی در سلولهای سرطانی مورد استفاده قرار گیرند. به گزارش سرویس فناوری ایسنا، منافذ این نانوذرات میتوانند برای جابهجایی داروی ضدسرطان دوکسوروبیسین و نوع خاصی از ریبونوکلئیک اسید (RNA) استفاده شود. در مرحله بعد این دو دارو به طور موثری در نواحی توموری، در موشهایی که سلولهای سرطانی سینه مقاوم در برابر دارو به آنها پیوند زده شده است، آزاد شدند. اکثر روشهای شیمیدرمانی شامل ترکیب چند داروی معالج برای جلوگیری از مقاومت دارویی در بیماران مبتلا به سرطان است. با این وجود، سلولهای سرطانی میتوانند خود را در مقابل بیشتر داروهای مورد استفاده سازگار و مقاوم کنند؛ مسالهای که در نهایت منجر به شکست طرح درمان میشود. محققان کلینیک مایو، مکانیسم چگونگی کارآمدکردن نانوذرات طلا علیه سلولهای سرطان تخمدان را شناسایی کردند. نانوذرات طلای باردار مثبت، معمولا برای سلولها سمی هستند، اما سلولهای سرطانی از مسمومشدن توسط آنها، اجتناب میکنند. مطالعه جدید مکانیسم نوینی را شناسایی میکند که با جلوگیری از مرگ سلول یا آپوپتوز(که هنگام برخورد با نانوذرات باردار رخ میدهد) از سلولهای سرطانی تخمدان محافظت میکند. با اعمال بارهای یونی مثبت بر روی سطح سلول، نانوذرات به عنوان نابودگر سلولهای توموری عمل کرده در حالی که سلولهای سالم را به حال خود رها میکنند.
محققان کلینیک مایو، مکانیسم چگونگی کارآمدکردن نانوذرات طلا علیه سلولهای سرطان تخمدان را شناسایی کردند. نانوذرات طلای باردار مثبت، معمولا برای سلولها سمی هستند، اما سلولهای سرطانی از مسمومشدن توسط آنها، اجتناب میکنند. مطالعه جدید مکانیسم نوینی را شناسایی میکند که با جلوگیری از مرگ سلول یا آپوپتوز(که هنگام برخورد با نانوذرات باردار رخ میدهد) از سلولهای سرطانی تخمدان محافظت میکند. با اعمال بارهای یونی مثبت بر روی سطح سلول، نانوذرات به عنوان نابودگر سلولهای توموری عمل کرده در حالی که سلولهای سالم را به حال خود رها میکنند.  محققان دانشگاه کوئینز بلفاست یک نانوداروی «گلوله جادویی» را طراحی کرده اند که میتواند اولین درمان موثر برای آسیبدیدگی حاد ریه باشد. عوامل اصلی این بیماری تصادفات جادهای و عفونت بوده و بسیاری از مبتلایان به آن در اثر نارسایی ریه میمیرند. بیماران مبتلا به آسیبهای حاد ریه اغلب نیازمند دستگاه کمک تنفس بوده و در حال حاضر درمان موثری برای این بیماری وجود ندارد اما در یک همکاری مشترک بین دانشکده داروسازی و مرکز عفونت و ایمنی دانشگاه کوئینز، دانشمندان توانستهاند داروی جدیدی را تولید کنند که میتواند مدیریت بالینی بیماران را در بخشهای آیسییو متحول کند.
محققان دانشگاه کوئینز بلفاست یک نانوداروی «گلوله جادویی» را طراحی کرده اند که میتواند اولین درمان موثر برای آسیبدیدگی حاد ریه باشد. عوامل اصلی این بیماری تصادفات جادهای و عفونت بوده و بسیاری از مبتلایان به آن در اثر نارسایی ریه میمیرند. بیماران مبتلا به آسیبهای حاد ریه اغلب نیازمند دستگاه کمک تنفس بوده و در حال حاضر درمان موثری برای این بیماری وجود ندارد اما در یک همکاری مشترک بین دانشکده داروسازی و مرکز عفونت و ایمنی دانشگاه کوئینز، دانشمندان توانستهاند داروی جدیدی را تولید کنند که میتواند مدیریت بالینی بیماران را در بخشهای آیسییو متحول کند. یک گروه بینالمللی از محققان نوع جدیدی از ماهیچه مصنوعی ساختهاند که از نخهایی از رشتههای نانولوله کربنی درهمپیچیدهی آغشته به موم پارافین تشکیل شده است. این ساختارهای محرک جدید از این لحاظ که به الکترولیت خارجی برای عمل کردن نیاز ندارند، با افزارههای ساخته شده قبلی متفاوت هستند. این ماهیچهها میتوانند 100 هزار برابر وزنشان را جابجا کنند، بینهایت سریع منبسط و منقبض شوند و در گستره دمایی وسیعی عمل کنند. چنین خواصی میتواند آنها را برای استفاده در گسترهای از کاربردها از قبیل روباتهای انساننما، منسوجات هوشمند و موتورهای چرخشی پیشرفته ایدهآل کند.
یک گروه بینالمللی از محققان نوع جدیدی از ماهیچه مصنوعی ساختهاند که از نخهایی از رشتههای نانولوله کربنی درهمپیچیدهی آغشته به موم پارافین تشکیل شده است. این ساختارهای محرک جدید از این لحاظ که به الکترولیت خارجی برای عمل کردن نیاز ندارند، با افزارههای ساخته شده قبلی متفاوت هستند. این ماهیچهها میتوانند 100 هزار برابر وزنشان را جابجا کنند، بینهایت سریع منبسط و منقبض شوند و در گستره دمایی وسیعی عمل کنند. چنین خواصی میتواند آنها را برای استفاده در گسترهای از کاربردها از قبیل روباتهای انساننما، منسوجات هوشمند و موتورهای چرخشی پیشرفته ایدهآل کند. دانشمندان موفق به طراحی نوعی لحیم مبتنی بر طلا شدند که با آن میتوان بافتها را در نواحی مانند رودهها به صورت محکمتر و مطمئنتر جوش زد. سیستم لحیمکاری روده، از یک لیزر برای گرمادادن دقیق به بافت در لبههای زخم استفاده میکند. این امر موجب میشود ساختار ماتریس خارج سلولی بافت موردنظر، تغییر کند و دو لبه امکان جوشخوردن پیدا کنند. انجام این فرایند و همچنین التیام مهر و موم حاصل آن سریعتر است و جای بخیه کمتری را در مقایسه با بخیه معمولی بر جا میگذارد؛ با این حال، مهر و مومهای تشکیلشده محکم و قوی نیستند. این موضوع در ارگانهایی مانند روده مشکلآفرین است، زیرا بازشدن مهر و موم و تراوش محتویات رودهها به بیرون، منجر به بروز عفونت مرگبار خواهد شد.
دانشمندان موفق به طراحی نوعی لحیم مبتنی بر طلا شدند که با آن میتوان بافتها را در نواحی مانند رودهها به صورت محکمتر و مطمئنتر جوش زد. سیستم لحیمکاری روده، از یک لیزر برای گرمادادن دقیق به بافت در لبههای زخم استفاده میکند. این امر موجب میشود ساختار ماتریس خارج سلولی بافت موردنظر، تغییر کند و دو لبه امکان جوشخوردن پیدا کنند. انجام این فرایند و همچنین التیام مهر و موم حاصل آن سریعتر است و جای بخیه کمتری را در مقایسه با بخیه معمولی بر جا میگذارد؛ با این حال، مهر و مومهای تشکیلشده محکم و قوی نیستند. این موضوع در ارگانهایی مانند روده مشکلآفرین است، زیرا بازشدن مهر و موم و تراوش محتویات رودهها به بیرون، منجر به بروز عفونت مرگبار خواهد شد.  اخیرا روشی برای رهاسازی DNA و RNA درون یک سلول سرطانی ارائه شده است. در این روش از مولکولهای چربی در مقیاس نانو استفاده میشود. پزشکی مدرن بدنبال این است که از داروهای کوچک استفاده کند؛ داروهایی که حاوی مسکنهایی نظیر آسپرین و آنتیبیوتیکهایی نظیر پنیسیلین هستند. این داروها طول عمر بشر را افزایش میدهند. اخیرا محققان روشی یافتهاند که با استفاده از آن میتوان رهاسازی دارو را در مقیاس نانو انجام داد که این روش کارایی بیشتری نسبت به روشهای پیشین دارد. با رهاسازی DNA و RNA درون یک سلول خاص، میتوان به صورت خاص یک ژن را روشن یا خاموش کرد. از سوی دیگر یک سیستم نانومقیاس درون بدن قرار میگیرد که میتواند امکان ردیابی دارو را در بافتهای خاصی فراهم کند، همچنین این سیستم میتواند در یک دوره زمانی تعریف شده رهاسازی را انجام دهد.
اخیرا روشی برای رهاسازی DNA و RNA درون یک سلول سرطانی ارائه شده است. در این روش از مولکولهای چربی در مقیاس نانو استفاده میشود. پزشکی مدرن بدنبال این است که از داروهای کوچک استفاده کند؛ داروهایی که حاوی مسکنهایی نظیر آسپرین و آنتیبیوتیکهایی نظیر پنیسیلین هستند. این داروها طول عمر بشر را افزایش میدهند. اخیرا محققان روشی یافتهاند که با استفاده از آن میتوان رهاسازی دارو را در مقیاس نانو انجام داد که این روش کارایی بیشتری نسبت به روشهای پیشین دارد. با رهاسازی DNA و RNA درون یک سلول خاص، میتوان به صورت خاص یک ژن را روشن یا خاموش کرد. از سوی دیگر یک سیستم نانومقیاس درون بدن قرار میگیرد که میتواند امکان ردیابی دارو را در بافتهای خاصی فراهم کند، همچنین این سیستم میتواند در یک دوره زمانی تعریف شده رهاسازی را انجام دهد.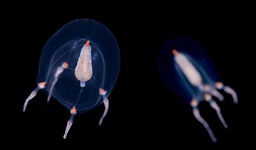 محققان آمریکایی با الهام از عروس دریایی، ساختاری ارائه کردهاند که میتواند برای تولید ادوات پزشکی ایمن مورد استفاده قرار گیرد. برخی ادوات پزشکی که در داخل بدن قرار میگیرند، نیازمند به همراه داشتن قطعاتی از جنس مواد سخت هستند. این ناهمگونی مکانیکی میتواند برای بافتهایی نظیر پوست مشکل ساز شود. اخیرا پژوهشگران موفق به ساخت سیستمی شدند که همانند عروس دریایی دارای بدنه نرم و دهانه سخت است. عروس دریایی هرچند بدنه نرمی دارد، اما دارای دندانهای تیزی است که قادر به وارد کردن فشار بر غذا است. با الهام از این جاندار دریایی، محققان سیستمی ساختند که برای بیماران بیخطر و ایمن است، به طوری که از آن میتوان برای ساخت حسگرهای گلوکز و بازوهای پروتزی استفاده کرد. نتایج این پژوهش در قالب مقالهای تحت عنوان «Bioinspired Water-Enhanced Mechanical Gradient Nanocomposite Films That Mimic the Architecture and Properties of the Squid Beak» در نشریه «Journal of the American Chemical Society» به چاپ رسیده است.
محققان آمریکایی با الهام از عروس دریایی، ساختاری ارائه کردهاند که میتواند برای تولید ادوات پزشکی ایمن مورد استفاده قرار گیرد. برخی ادوات پزشکی که در داخل بدن قرار میگیرند، نیازمند به همراه داشتن قطعاتی از جنس مواد سخت هستند. این ناهمگونی مکانیکی میتواند برای بافتهایی نظیر پوست مشکل ساز شود. اخیرا پژوهشگران موفق به ساخت سیستمی شدند که همانند عروس دریایی دارای بدنه نرم و دهانه سخت است. عروس دریایی هرچند بدنه نرمی دارد، اما دارای دندانهای تیزی است که قادر به وارد کردن فشار بر غذا است. با الهام از این جاندار دریایی، محققان سیستمی ساختند که برای بیماران بیخطر و ایمن است، به طوری که از آن میتوان برای ساخت حسگرهای گلوکز و بازوهای پروتزی استفاده کرد. نتایج این پژوهش در قالب مقالهای تحت عنوان «Bioinspired Water-Enhanced Mechanical Gradient Nanocomposite Films That Mimic the Architecture and Properties of the Squid Beak» در نشریه «Journal of the American Chemical Society» به چاپ رسیده است. یک تیم تحقیقاتی در دانشگاه پنسیلوانیا با استفاده از اتصال آنتی بادی ویژهای روی نانولوله کربنی موفق به ساخت دستگاه شناساگر بیماری لایم شده است. تشخیص زودهنگام، در شناسایی بیماری لایم بسیار مهم است. در حال حاضر یک چهارم از این بیماران به دلیل حساسیت اندک ادوات تشخیص پزشکی، بیماریشان به اشتباه چیز دیگری شناسایی میشود. عدم تشخیص درست بیماری باعث میشود تا درمان بهموقع انجام نشده و بیمار در مراحل حاد بیماری تحت درمان قرار گیرد؛ زمانی که طول درمان به درازا خواهد کشید و ممکن است آثار طولانی مدتی روی بیمار داشته باشد. درحال حاضر از روش شناسایی آنتیبادیهایی مربوط به پروتئین باکتری، بیماری شناسایی میشود که این کار چندین هفته بعد از آلودگی بدن قابل انجام است. اما اخیرا محققان دانشگان پنسیلوانیا موفق به ارائه روشی شدند که خود باکتری را شناسایی میکند.
یک تیم تحقیقاتی در دانشگاه پنسیلوانیا با استفاده از اتصال آنتی بادی ویژهای روی نانولوله کربنی موفق به ساخت دستگاه شناساگر بیماری لایم شده است. تشخیص زودهنگام، در شناسایی بیماری لایم بسیار مهم است. در حال حاضر یک چهارم از این بیماران به دلیل حساسیت اندک ادوات تشخیص پزشکی، بیماریشان به اشتباه چیز دیگری شناسایی میشود. عدم تشخیص درست بیماری باعث میشود تا درمان بهموقع انجام نشده و بیمار در مراحل حاد بیماری تحت درمان قرار گیرد؛ زمانی که طول درمان به درازا خواهد کشید و ممکن است آثار طولانی مدتی روی بیمار داشته باشد. درحال حاضر از روش شناسایی آنتیبادیهایی مربوط به پروتئین باکتری، بیماری شناسایی میشود که این کار چندین هفته بعد از آلودگی بدن قابل انجام است. اما اخیرا محققان دانشگان پنسیلوانیا موفق به ارائه روشی شدند که خود باکتری را شناسایی میکند.  حاملین نانومقیاس حاوی برخی پروتئینها و اسیدهای نوکلئیک میتوانند برای تشخیص، رصد و درمان سرطان مغز مورد استفاده قرار گیرند. اخیرا مقالهای توسط یک تیم تحقیقاتی از دانشگاه کالیفرنیا و بیمارستان عمومی ماساچوست در نشریه «Neurosurgery» به چاپ رسیده که در آن آخرین پیشرفتهای انجام شده در بخش تومور مغز مورد بحث قرار گرفته است. در این مقاله با عنوان "the biological processes mediated by these EVs and their applications as biomarkers for brain tumor diagnosis, monitoring, and therapeutic development" ، محققان به ارائه فرصتهای موجود در استفاده از حاملین نانومقیاس برای رهاسازی دارو پرداختهاند. نویسندگان این مقاله از واژه حاملین خارج سلولی استفاده کردند که این عبارت به اجزای سلولی کپسوله شده در میان یک غشاء گفته میشود. حاملین خارج سلولی را میتوان از تمام سیالهای موجود در بدن نظیر خون و مایع نخاعی بیماران دارای تومور مغزی استخراج کرد. حاملین خارج سلولی شبیه حبابهای نانومقیاس هستند که توسط سلولهای بدن ارسال میشوند؛ این حاملین حاوی پروتئین و دیگر مواد سلولی نظیر اسیدهای نوکلئیک هستند.
حاملین نانومقیاس حاوی برخی پروتئینها و اسیدهای نوکلئیک میتوانند برای تشخیص، رصد و درمان سرطان مغز مورد استفاده قرار گیرند. اخیرا مقالهای توسط یک تیم تحقیقاتی از دانشگاه کالیفرنیا و بیمارستان عمومی ماساچوست در نشریه «Neurosurgery» به چاپ رسیده که در آن آخرین پیشرفتهای انجام شده در بخش تومور مغز مورد بحث قرار گرفته است. در این مقاله با عنوان "the biological processes mediated by these EVs and their applications as biomarkers for brain tumor diagnosis, monitoring, and therapeutic development" ، محققان به ارائه فرصتهای موجود در استفاده از حاملین نانومقیاس برای رهاسازی دارو پرداختهاند. نویسندگان این مقاله از واژه حاملین خارج سلولی استفاده کردند که این عبارت به اجزای سلولی کپسوله شده در میان یک غشاء گفته میشود. حاملین خارج سلولی را میتوان از تمام سیالهای موجود در بدن نظیر خون و مایع نخاعی بیماران دارای تومور مغزی استخراج کرد. حاملین خارج سلولی شبیه حبابهای نانومقیاس هستند که توسط سلولهای بدن ارسال میشوند؛ این حاملین حاوی پروتئین و دیگر مواد سلولی نظیر اسیدهای نوکلئیک هستند.