..:::: درمان سرطانهاي کولورکتال با پليمرهاي نانو ذرهاي ::::..
پژوهشگـران مرکــز ويک فارست آمريکا اقدام به توليد نــوع جديدي از نانــوذرات کردهاند که احتمالا ميتواند در آينده براي درمان سرطانهاي کولورکتال مورد استفاده قرار گيرد. در مطالعه اين پژوهشگران، پليمرهاي نانوذرهاي کونژوگه شکاف باند پائين Low band gap D-A conjugatecl) D-A) که حاوي سيکلوپنتاديتيوفن 2 اتيل هگزيل بودند با بنزوديتاديازول يا بنزوسلناديازول به طور همزمان پليمريزه شدند. پلي مرهاي توليد شده، در محيط مايع پايدار بوده و تا غلظت يک ميليگرم در هر ميلي ليتر از مايع، براي سلولها سميت هم نداشتند. سپس اين پليمرها در معرض نور با طول موج 808 نانومتر قرار گرفتند که باعث ايجاد حرارت تا بالاتر از 50 درجه سانتيگراد گرديد. مواجهه سلولهاي کولورکتال در محيط آزمايشگاهي با اين پليمرها در غلظت 100 ميکروگرم در هر ميليليتر و سپس مواجهه با امواج نوري مزبور، نابودسازي فوتوترمال سلولهاي سرطاني را اثبات کرد، به طوري که تنها کمتر از 10% از سلولهاي سرطاني زنده باقي ماندند. با اين حساب، پليمرهاي مزبور پيش از مواجهه با نور خاصيت کشندگي ندارند اما بعداز مواجهه با نور به علت ايجاد گرما قادر به از بين بردن سلولهاي سرطاني هستند و بنابراين ميتوان از آنها در درمان سرطانهاي کولورکتال و حتي ديگر سرطانها استفاده کرد. پيش از هر گونه استفاده باليني، نياز به بررسيهاي بيشتر در اين زمينه وجود دارد.
 دانشمندان در تلاش برای استفاده از نانوذرات پلاسمونیکی در درمان سرطان هستند که به موجب آن انرژی نور به منظور کشتن سلولهای سرطانی به گرما تبدیل میشود.
دانشمندان در تلاش برای استفاده از نانوذرات پلاسمونیکی در درمان سرطان هستند که به موجب آن انرژی نور به منظور کشتن سلولهای سرطانی به گرما تبدیل میشود.  محققان دانشگاه صنعتی مونیخ حسگر جدیدی مبتنی بر حفرههای نانومقیاس از جنس نیمههادی تولید کردهاند.
محققان دانشگاه صنعتی مونیخ حسگر جدیدی مبتنی بر حفرههای نانومقیاس از جنس نیمههادی تولید کردهاند.  دانشمندان دانشگاه میسوری ثابت کردهاند درمانی که برای سرطان پروستات از نانوذرات طلای رادیواکتیو استفاده میکند، برای استفاده در سگها بیخطر است.
دانشمندان دانشگاه میسوری ثابت کردهاند درمانی که برای سرطان پروستات از نانوذرات طلای رادیواکتیو استفاده میکند، برای استفاده در سگها بیخطر است.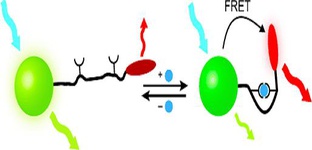 پژوهشگران
پژوهشگران پژوهشگران موسسه فناوری سلطنتی ملبورن، نانوذراتی تولید کردهاند که بسیار ارزان و غیرسمی بوده و از آن میتوان برای رادیودرمانی سرطان استفاده کرد.
پژوهشگران موسسه فناوری سلطنتی ملبورن، نانوذراتی تولید کردهاند که بسیار ارزان و غیرسمی بوده و از آن میتوان برای رادیودرمانی سرطان استفاده کرد. محققان دانشگاه رایس روشی ارائه کردهاند که با استفاده از آن میتوان برخی سلولهای بیمار را از بین برد و برخی دیگر را درمان کرد.
محققان دانشگاه رایس روشی ارائه کردهاند که با استفاده از آن میتوان برخی سلولهای بیمار را از بین برد و برخی دیگر را درمان کرد.  شرکت آیبیام از یک ژل فناوری پیشرفته رونمایی کرده که میتواند باکتریهای مضر را از بین ببرد
شرکت آیبیام از یک ژل فناوری پیشرفته رونمایی کرده که میتواند باکتریهای مضر را از بین ببرد محققان دانشگاه نورث وسترن میگویند با استفاده از فناوری نانو موفق به برداشتن گامهای موثری در درمان بیماری ام اس شدهاند. در این پروژه آنها از نانوذرات قابل تجزیه جهت حمل دارو استفاده کردند. این نانوذرات میتواند سیستم ایمنی بدن را فریب دهد. در بیماری ام اس، سیستم ایمنی بدن به غشاء میلن حمله میکند، غشائی که سلولهای عصبی مغز، نخاع و اعصاب بینایی را پوشانده است. زمانی که این پوشش عایق از بین رود، سیگنالهای عصبی قادر نیستند به شکل صحیحی در مسیر عصبی حرکت کنند در نتیجه اثراتی از بیحسی موضعی گرفته تا کوری یا رعشه در بدن دیده میشود.
محققان دانشگاه نورث وسترن میگویند با استفاده از فناوری نانو موفق به برداشتن گامهای موثری در درمان بیماری ام اس شدهاند. در این پروژه آنها از نانوذرات قابل تجزیه جهت حمل دارو استفاده کردند. این نانوذرات میتواند سیستم ایمنی بدن را فریب دهد. در بیماری ام اس، سیستم ایمنی بدن به غشاء میلن حمله میکند، غشائی که سلولهای عصبی مغز، نخاع و اعصاب بینایی را پوشانده است. زمانی که این پوشش عایق از بین رود، سیگنالهای عصبی قادر نیستند به شکل صحیحی در مسیر عصبی حرکت کنند در نتیجه اثراتی از بیحسی موضعی گرفته تا کوری یا رعشه در بدن دیده میشود. زخمهای وارده بر مغز یکی از مشکلاتی است که روش درمانی نداشته و میتواند موجب مرگ شده یا تا پایان عمر اثر آن باقی بماند. اخیرا محققان آمریکایی ساختارهایی ارائه کردهاند که میتواند کاهش فشار خون را کنترل کرده و در به هوش آوردن مصدوم کمک کند. دچار آسیبهای مغزی میشوند، اخیرا محققان برای این مشکل راه حلی پیدا کردهاند. زخمهای مغزی ایجاد شده بوسیله ضربههای فیزیکی معمولا در اثر برخورد جسم سخت بر جمجمه یا برخورد گلوله ایجاد میشود. این زخمها معمولا درمان نشده و به صورت آسیب دائمی در مغز مانده و یا حتی موجب مرگ میشود.
زخمهای وارده بر مغز یکی از مشکلاتی است که روش درمانی نداشته و میتواند موجب مرگ شده یا تا پایان عمر اثر آن باقی بماند. اخیرا محققان آمریکایی ساختارهایی ارائه کردهاند که میتواند کاهش فشار خون را کنترل کرده و در به هوش آوردن مصدوم کمک کند. دچار آسیبهای مغزی میشوند، اخیرا محققان برای این مشکل راه حلی پیدا کردهاند. زخمهای مغزی ایجاد شده بوسیله ضربههای فیزیکی معمولا در اثر برخورد جسم سخت بر جمجمه یا برخورد گلوله ایجاد میشود. این زخمها معمولا درمان نشده و به صورت آسیب دائمی در مغز مانده و یا حتی موجب مرگ میشود.  استفاده از نانوذرات جدید جهت درمان سرطانها، تحویل دارو به بافتهای سالم را کاهش میدهد. محققان دانشگاه کیس وسترن با انجام بررسیهای خود توانستند به نانوذرات جدیدی دستیابی پیدا کنند که ضمن رساندن داروها به سلولهای تومورال، انتقال آنها به سلولهای غیرهدف و سالم را به حداقل میرساند. استفاده از این نانو ذرات در مدل حیوانی توانست به مدت بیشتری در گردش خون گروه مورد آزمایش باقی بماند و رسوب بیشتری را در داخل تومورها نشان دهد. تحقیقات قبلی نشان دادهاند داروهای وابسته به نانوذرات در بسیاری از سلولهای سرطانی انتقال نمییابند زیرا تحویل آنها به سلولهای تومورال به طور یکنواخت نبوده و در نتیجه مقادیر عظیمی از آنها در اطراف عروق جمع میشوند. به گفته محققان استفاده از این نانو ذرات جدید بر اساس نانو زنجیرههای چند بخشی منجر به رساندن داروها به بیشتر سلولهای سرطانی شده و باعث از بین رفتن سلولهای توموری میشود. یافتههای این تحقیق در نشریه نانو ACS منتشر شده است.
استفاده از نانوذرات جدید جهت درمان سرطانها، تحویل دارو به بافتهای سالم را کاهش میدهد. محققان دانشگاه کیس وسترن با انجام بررسیهای خود توانستند به نانوذرات جدیدی دستیابی پیدا کنند که ضمن رساندن داروها به سلولهای تومورال، انتقال آنها به سلولهای غیرهدف و سالم را به حداقل میرساند. استفاده از این نانو ذرات در مدل حیوانی توانست به مدت بیشتری در گردش خون گروه مورد آزمایش باقی بماند و رسوب بیشتری را در داخل تومورها نشان دهد. تحقیقات قبلی نشان دادهاند داروهای وابسته به نانوذرات در بسیاری از سلولهای سرطانی انتقال نمییابند زیرا تحویل آنها به سلولهای تومورال به طور یکنواخت نبوده و در نتیجه مقادیر عظیمی از آنها در اطراف عروق جمع میشوند. به گفته محققان استفاده از این نانو ذرات جدید بر اساس نانو زنجیرههای چند بخشی منجر به رساندن داروها به بیشتر سلولهای سرطانی شده و باعث از بین رفتن سلولهای توموری میشود. یافتههای این تحقیق در نشریه نانو ACS منتشر شده است. دانشمندان چيني نانومادهاي ساختهاند كه زمان لازم براي بهبود زخمهاي پوستي را كاهش ميدهد. اين دانشمندان براي تهيه نانوالياف چيتوسان- پلي وينيل الكل (PVA) حاوي گرافن، از روش الكتروريسندگي استفاده كردهاند. اين نانوالياف ميتوانند مستقيما براي بهبود زخمها مورد استفاده قرار گيرند. گرافن نيز به عنوان يك ماده ضدباکتري ميتواند در اين زمينه موثر باشد. حقيقات مختلفي در زمينه كاربردهاي زيستپزشكي چيتوسان و تاثير لختهكنندگي خون انجام شده است. «بينگان لو» و همكارانش در دانشگاه «لانژو»، روش جديدي را براي تلفيق مزاياي چيتوسان و گرافن ابداع كردهاند كه نشاندهنده خواص ضدباکتري است.
دانشمندان چيني نانومادهاي ساختهاند كه زمان لازم براي بهبود زخمهاي پوستي را كاهش ميدهد. اين دانشمندان براي تهيه نانوالياف چيتوسان- پلي وينيل الكل (PVA) حاوي گرافن، از روش الكتروريسندگي استفاده كردهاند. اين نانوالياف ميتوانند مستقيما براي بهبود زخمها مورد استفاده قرار گيرند. گرافن نيز به عنوان يك ماده ضدباکتري ميتواند در اين زمينه موثر باشد. حقيقات مختلفي در زمينه كاربردهاي زيستپزشكي چيتوسان و تاثير لختهكنندگي خون انجام شده است. «بينگان لو» و همكارانش در دانشگاه «لانژو»، روش جديدي را براي تلفيق مزاياي چيتوسان و گرافن ابداع كردهاند كه نشاندهنده خواص ضدباکتري است. تیمی بینالمللی از دانشمندان مستقر در دانشگاه تگزاس موفق به تولید نوع جدید ماهیچه مصنوعی با استفاده از نانوتیوبهای کربن شدند. این نانوتیوبها سیلندرهای ریز توخالی هستند که از همان لایههای گرافیت مورد استفاده در مغز مدادهای استاندارد ساخته شدهاند. بر خلاف این واقعیت که عضلات جدید 10 هزار برابر کوچکتر از قطر موی انسان هستند، آنها قادرند بیش از 100 هزار برابر وزن خود را از جا بلند کنند که این میزان تقریباً 85 برابر قدرت ماهیچه طبیعی با سایز معادل عنوان شده است. عضلات طراحی شده با استفاده از یک نخ تاب خورده سیلندرهای کربنی ناچیز و سپس تعبیه یک "مهمان" تغییردهنده حجم (در این حالت موم پارافین مورد استفاده در شمع) در درون آنها، تولید شدهاند. نخ پوشیده شده از موم سپس به صورت الکتریکی یا توسط جرقهیی از نور حرارت داده میشود. این امر موجب انبساط موم، افزایش حجم نخ و انقباض طول ماده میشود. این انقباض ماهیچهیی یا تحریک (actuation) میتواند در فقط 25 هزارم ثانیه رخ دهد.
تیمی بینالمللی از دانشمندان مستقر در دانشگاه تگزاس موفق به تولید نوع جدید ماهیچه مصنوعی با استفاده از نانوتیوبهای کربن شدند. این نانوتیوبها سیلندرهای ریز توخالی هستند که از همان لایههای گرافیت مورد استفاده در مغز مدادهای استاندارد ساخته شدهاند. بر خلاف این واقعیت که عضلات جدید 10 هزار برابر کوچکتر از قطر موی انسان هستند، آنها قادرند بیش از 100 هزار برابر وزن خود را از جا بلند کنند که این میزان تقریباً 85 برابر قدرت ماهیچه طبیعی با سایز معادل عنوان شده است. عضلات طراحی شده با استفاده از یک نخ تاب خورده سیلندرهای کربنی ناچیز و سپس تعبیه یک "مهمان" تغییردهنده حجم (در این حالت موم پارافین مورد استفاده در شمع) در درون آنها، تولید شدهاند. نخ پوشیده شده از موم سپس به صورت الکتریکی یا توسط جرقهیی از نور حرارت داده میشود. این امر موجب انبساط موم، افزایش حجم نخ و انقباض طول ماده میشود. این انقباض ماهیچهیی یا تحریک (actuation) میتواند در فقط 25 هزارم ثانیه رخ دهد. در یک دستاورد بزرگ برای فناوری نانو و بیماری اماس، محققان دانشگاه نورثوسترن موفق به ساخت یک نانوذره تجزیهپذیر شدهاند که یک خودروی عالی برای انتقال مخفیانه پادتن برای تحریک سیستم ایمنی و توقف حملات آن به میلین و یک مدل اماس عودکننده فروکش کننده در موشها بوده است. ین نانوفناوری جدید همچنین در طیف گستردهای از بیماریهای مرتبط با ایمنی از جمله دیابت نوع یک، حساسیتهای غذایی و هوایی مانند آسم قابل اجرا است.
در یک دستاورد بزرگ برای فناوری نانو و بیماری اماس، محققان دانشگاه نورثوسترن موفق به ساخت یک نانوذره تجزیهپذیر شدهاند که یک خودروی عالی برای انتقال مخفیانه پادتن برای تحریک سیستم ایمنی و توقف حملات آن به میلین و یک مدل اماس عودکننده فروکش کننده در موشها بوده است. ین نانوفناوری جدید همچنین در طیف گستردهای از بیماریهای مرتبط با ایمنی از جمله دیابت نوع یک، حساسیتهای غذایی و هوایی مانند آسم قابل اجرا است. محققان نانوزنجیرهایی ساختهاند که قبل از تبدیل شدن سلولهای متاستاز به یک بافت جدید، روی آنها قرار گرفته و با استفاده از تصویربرداری تشدید مغناطیسی (MRI) محل آنها را شناسایی میکنند. سلولهای بدخیم که از تومور اولیه جدا میشوند، در کل بدن به شکلی غیرقابل کنترل پخش شده و با ایجاد تومورهای جدید در نقاط دیگر، موجب مرگ بیمار میشوند. حال گروهی از محققان دانشگاه «Case Western Reserve» روشی برای تشخیص این متاستازها در سرطان سینه موش یافتهاند که میتواند بسیار زودتر از روشهای فعلی، این سلولهای جابهجاشونده را شناسایی کند؛ با استفاده از این روش امکان تشخیص زودهنگام متاستاز و نجات بیماران سرطانی ایجاد میشود.
محققان نانوزنجیرهایی ساختهاند که قبل از تبدیل شدن سلولهای متاستاز به یک بافت جدید، روی آنها قرار گرفته و با استفاده از تصویربرداری تشدید مغناطیسی (MRI) محل آنها را شناسایی میکنند. سلولهای بدخیم که از تومور اولیه جدا میشوند، در کل بدن به شکلی غیرقابل کنترل پخش شده و با ایجاد تومورهای جدید در نقاط دیگر، موجب مرگ بیمار میشوند. حال گروهی از محققان دانشگاه «Case Western Reserve» روشی برای تشخیص این متاستازها در سرطان سینه موش یافتهاند که میتواند بسیار زودتر از روشهای فعلی، این سلولهای جابهجاشونده را شناسایی کند؛ با استفاده از این روش امکان تشخیص زودهنگام متاستاز و نجات بیماران سرطانی ایجاد میشود. دانشمندان چینی توانستهاند که با استفاده از یک زیستحسگر نانوسیمی دو نوع مختلف آنفلوآنزا را در عرض چند دقیقه تشخیص دهند. این دانشمندان امیدوارند که افزاره آنها انقلابی در تشخیص آنفلوآنزا ایجاد کند و شیوع بیماری را در یک رخداد فراگیر به کنترل درآورد. اپیدمیهای سالیانه آنفلوآنزا توسط دو نوع اصلی رخ میدهند و منجر به پنج میلیون مورد وخیم در سال با بیش از 500 هزار مرگ میشوند. آنفلوآنزای A انسانی یا از نوع H3N2 است یا H1N1 که به آنفلوانزای خوکی نیز معروف است. سهولت انتقال این بیماری، یک تست تشخیصی ساده و معتبر برای پزشکان مهیا میکند.
دانشمندان چینی توانستهاند که با استفاده از یک زیستحسگر نانوسیمی دو نوع مختلف آنفلوآنزا را در عرض چند دقیقه تشخیص دهند. این دانشمندان امیدوارند که افزاره آنها انقلابی در تشخیص آنفلوآنزا ایجاد کند و شیوع بیماری را در یک رخداد فراگیر به کنترل درآورد. اپیدمیهای سالیانه آنفلوآنزا توسط دو نوع اصلی رخ میدهند و منجر به پنج میلیون مورد وخیم در سال با بیش از 500 هزار مرگ میشوند. آنفلوآنزای A انسانی یا از نوع H3N2 است یا H1N1 که به آنفلوانزای خوکی نیز معروف است. سهولت انتقال این بیماری، یک تست تشخیصی ساده و معتبر برای پزشکان مهیا میکند.  گروهی از پژوهشگران انجمن مهندسی و پژوهشی مواد «A*STAR» خانوادهای از رنگدانهها طراحی کردهاند که خاصیت فلورسانسی آنها با تودهای شدن افزایش مییابد. انتظار میرود نانوذرات فلورسانسی پرشده با رنگدانههای آلی گسیلنده نور، انقلابی در فناوریهای تصویربرداری زیستی ایجاد کنند. هنگامی که رنگدانههای متداول با غلظت زیاد همراه نانوذرات استفاده میشوند، به صورت توده درآمده و شدت گسیل خود را از دست میدهند. درون رنگدانههای متداول یک کروموفور (عامل رنگی مولکولی) تخت به نام دیسیانومتیلن اصلاح شده- تریفنیلآمین وجود دارد که در محلولهای رقیق نور قرمز گسیل میکند، ولی به هنگام تودهای شدن فلورسانس ضعیفی دارد.
گروهی از پژوهشگران انجمن مهندسی و پژوهشی مواد «A*STAR» خانوادهای از رنگدانهها طراحی کردهاند که خاصیت فلورسانسی آنها با تودهای شدن افزایش مییابد. انتظار میرود نانوذرات فلورسانسی پرشده با رنگدانههای آلی گسیلنده نور، انقلابی در فناوریهای تصویربرداری زیستی ایجاد کنند. هنگامی که رنگدانههای متداول با غلظت زیاد همراه نانوذرات استفاده میشوند، به صورت توده درآمده و شدت گسیل خود را از دست میدهند. درون رنگدانههای متداول یک کروموفور (عامل رنگی مولکولی) تخت به نام دیسیانومتیلن اصلاح شده- تریفنیلآمین وجود دارد که در محلولهای رقیق نور قرمز گسیل میکند، ولی به هنگام تودهای شدن فلورسانس ضعیفی دارد.  محققان «BWH» اولين گروهي هستند که طراحي منطقي دارو را با نانوشيمي ابرمولکولي ترکيب کرده و از آن در درمان سرطان استفاده کردهاند. شيمي ابرمولکولي به معني توليد سامانههاي پيچيده شيميايي با استفاده از واحدهاي ساختماني مولکولي است. محققان بيمارستان بريگام و زنان (BWH) از اين روشها براي ايجاد نانوذراتي استفاده کردهاند که در حين دارا بودن سميت پايين، فعاليت ضدتوموري بالايي روي سرطان سينه و رحم از خود نشان ميدهند. «شيلاديتيا سنگوپتا»، استاديار مهندسي زيستي «BWH» و نويسنده ارشد مقاله مربوط به اين کار ميگويد: اين کار فراتر از استفاده از فناوري نانو به عنوان حاملهاي رسانش دارو است و در حقيقت در حوزه مهندسي مجدد خود دارو و تبديل آن به نانودارو قرار ميگيرد.
محققان «BWH» اولين گروهي هستند که طراحي منطقي دارو را با نانوشيمي ابرمولکولي ترکيب کرده و از آن در درمان سرطان استفاده کردهاند. شيمي ابرمولکولي به معني توليد سامانههاي پيچيده شيميايي با استفاده از واحدهاي ساختماني مولکولي است. محققان بيمارستان بريگام و زنان (BWH) از اين روشها براي ايجاد نانوذراتي استفاده کردهاند که در حين دارا بودن سميت پايين، فعاليت ضدتوموري بالايي روي سرطان سينه و رحم از خود نشان ميدهند. «شيلاديتيا سنگوپتا»، استاديار مهندسي زيستي «BWH» و نويسنده ارشد مقاله مربوط به اين کار ميگويد: اين کار فراتر از استفاده از فناوري نانو به عنوان حاملهاي رسانش دارو است و در حقيقت در حوزه مهندسي مجدد خود دارو و تبديل آن به نانودارو قرار ميگيرد.  محققان ایرلندی روشی برای تولید سلولهای مشابه عضلات قلب با استفاده از نانولولههای کربنی ارائه کردند که میتواند برای درمان بیمارانی که در اثر حمله قلبی دچار آسیب شدند، مفید باشد. پژوهشگران سلولهای بنیادین به دنبال استفاده از خواص الکتریکی نانومواد هستند تا از آنها برای توسعه سلولها جهت تولید سلولهای قلبی استفاده کنند. این تیم تحقیقاتی از موسسه پزشکی احیاء کننده (REMEDI) در دانشگاه ملی ایرلند با همکاری همتایان خود در کالج ترینیتی دوبلین روی این موضوع کار کردهاند.
محققان ایرلندی روشی برای تولید سلولهای مشابه عضلات قلب با استفاده از نانولولههای کربنی ارائه کردند که میتواند برای درمان بیمارانی که در اثر حمله قلبی دچار آسیب شدند، مفید باشد. پژوهشگران سلولهای بنیادین به دنبال استفاده از خواص الکتریکی نانومواد هستند تا از آنها برای توسعه سلولها جهت تولید سلولهای قلبی استفاده کنند. این تیم تحقیقاتی از موسسه پزشکی احیاء کننده (REMEDI) در دانشگاه ملی ایرلند با همکاری همتایان خود در کالج ترینیتی دوبلین روی این موضوع کار کردهاند.  بر اساس تحقيقي که در دانشگاه ملبورن استراليا انجام شده، ميتوان از کپسولهاي ساخته شده از پليروتاکسانها در ساخت نوع جديدي از حاملهاي دارورساني کارا و با سميت پايين استفاده کرد. ساختارهاي مطالعه شده در اين کار از سيکلودکسترينها و پلياتيلن گليکول ساخته شده بودند که هر دو، مولکولهاي کاملاً زيستتخريبپذير به شمار ميروند. روتاکسان يک ساختار مکانيکي درهم قفل شده است که از مولکولهاي دمبلي شکل رديف شده در يک ماکرومولکول حلقوي ساخته ميشود. مطالعه کمي روي کاربرد پلي روتاکسانها در دارورساني انجام شده است، اما با توجه به ويژگيهاي منحصر به فرد اين مولکولها (سفتي و زيستتخريبپذيري)، ميتوانند در حوزه رسانش دارو نويدبخش باشند.
بر اساس تحقيقي که در دانشگاه ملبورن استراليا انجام شده، ميتوان از کپسولهاي ساخته شده از پليروتاکسانها در ساخت نوع جديدي از حاملهاي دارورساني کارا و با سميت پايين استفاده کرد. ساختارهاي مطالعه شده در اين کار از سيکلودکسترينها و پلياتيلن گليکول ساخته شده بودند که هر دو، مولکولهاي کاملاً زيستتخريبپذير به شمار ميروند. روتاکسان يک ساختار مکانيکي درهم قفل شده است که از مولکولهاي دمبلي شکل رديف شده در يک ماکرومولکول حلقوي ساخته ميشود. مطالعه کمي روي کاربرد پلي روتاکسانها در دارورساني انجام شده است، اما با توجه به ويژگيهاي منحصر به فرد اين مولکولها (سفتي و زيستتخريبپذيري)، ميتوانند در حوزه رسانش دارو نويدبخش باشند.  پژوهشگران دانشگاه سيدني استراليا موفق به ساخت نانوذراتي شدند که احتمالا ميتواند در درمان سرطان ريه مفيد باشد. اين گروه تحقيقاتي در تازهترين مطالعات خود نانوذراتي توليد کردهاند که به تومورها حمله ميکند و در عين حال آسيبي به سلولهاي سالم نميرساند؛ بنابراين در درمان سرطان کمترين اثرات جانبي را خواهد داشت. درون اين نانوذرات از چربيهايي پر شده است که در صورت قرار گرفتن در ميدان مغناطيسي فعال ميشوند.
پژوهشگران دانشگاه سيدني استراليا موفق به ساخت نانوذراتي شدند که احتمالا ميتواند در درمان سرطان ريه مفيد باشد. اين گروه تحقيقاتي در تازهترين مطالعات خود نانوذراتي توليد کردهاند که به تومورها حمله ميکند و در عين حال آسيبي به سلولهاي سالم نميرساند؛ بنابراين در درمان سرطان کمترين اثرات جانبي را خواهد داشت. درون اين نانوذرات از چربيهايي پر شده است که در صورت قرار گرفتن در ميدان مغناطيسي فعال ميشوند.  دانشمندان توانستهاند با استفاده از روشی بالقوه، آسیب مغزی تروماتیک (TBI) را در محیط آزمایشگاهی و بر روی موشها با موفقیت درمان کنند. دکتر "توماس کنت"، "جیمز تور" و همکارانشان میگویند که «TBI» حتی اگر به صورت خفیف مانند بیهوشی مقطعی به هنگام صدمه مغزی باشد، ذخیره اکسیژن خون به مغز را قطع میکند، در این حالت مغز دچار نیاز شدید به اکسیژن میشود و پیرو آن پیامدهای مزمن و جدی رخ خواهد داد. این کاهش خونرسانی به مغز باعث ایجاد رادیکالهای آزاد میشود که میتواند سلولهای مغزی را از بین ببرد.
دانشمندان توانستهاند با استفاده از روشی بالقوه، آسیب مغزی تروماتیک (TBI) را در محیط آزمایشگاهی و بر روی موشها با موفقیت درمان کنند. دکتر "توماس کنت"، "جیمز تور" و همکارانشان میگویند که «TBI» حتی اگر به صورت خفیف مانند بیهوشی مقطعی به هنگام صدمه مغزی باشد، ذخیره اکسیژن خون به مغز را قطع میکند، در این حالت مغز دچار نیاز شدید به اکسیژن میشود و پیرو آن پیامدهای مزمن و جدی رخ خواهد داد. این کاهش خونرسانی به مغز باعث ایجاد رادیکالهای آزاد میشود که میتواند سلولهای مغزی را از بین ببرد.  پژوهشگران دانشگاه فلوریدا کشف کردهاند که یک کمپلکس نانوذرهای مصنوعی معروف به نانوزیم، میتواند با قطع ماده ژنتیکی ویروس به درمان عفونتهای ویروسی کمک کند. این رهیافت بدیع میتواند نقش ارزشمندی در ژنومیک کارکردی داشته باشد و توانایی ما را در برابر بیماریهای پروتئینی مانند عفونتهای ویروسی و سرطانها بهبود بخشد. این گروه نشان داد که نانوزیم طراحی شده برای درمان ویروس هپاتیت C (ویروس HCV) میتواند با تقلید از رفتار کمپکلسهای فرونشاننده بر اساس RNA سلولی (RISC) در سلولهای کشت شده و تست موشها، به طور فعال RNA ویروس HCV را قطعه قطعه کند. این روش بسیار موثر است؛ گروه مذکور شاهد کاهش بیش از 99 درصد در مقدار RNA ویروس HCV در موشهایی شد که با این نانوزیم درمان شده بودند.
پژوهشگران دانشگاه فلوریدا کشف کردهاند که یک کمپلکس نانوذرهای مصنوعی معروف به نانوزیم، میتواند با قطع ماده ژنتیکی ویروس به درمان عفونتهای ویروسی کمک کند. این رهیافت بدیع میتواند نقش ارزشمندی در ژنومیک کارکردی داشته باشد و توانایی ما را در برابر بیماریهای پروتئینی مانند عفونتهای ویروسی و سرطانها بهبود بخشد. این گروه نشان داد که نانوزیم طراحی شده برای درمان ویروس هپاتیت C (ویروس HCV) میتواند با تقلید از رفتار کمپکلسهای فرونشاننده بر اساس RNA سلولی (RISC) در سلولهای کشت شده و تست موشها، به طور فعال RNA ویروس HCV را قطعه قطعه کند. این روش بسیار موثر است؛ گروه مذکور شاهد کاهش بیش از 99 درصد در مقدار RNA ویروس HCV در موشهایی شد که با این نانوزیم درمان شده بودند.  دانشمندان دانشگاه استنفورد گامی مهم را در شیوه استفاده از میدانهای مغناطیسی برای کشتن تومورهای سرطانی برداشتند. از زمان ورود نانوفناوری ضد سرطان به حوزه پزشکی، محققان همواره درصدد استفاده از میدانهای مغناطیسی جهت افزایش تراکم نانو ذرات اکسید آهن سوار بر دارو در مسیر رسیدن به تومور بودهاند. با این حال میدانهای مغناطیسی با افزایش فاصله، سریعاً افت میکنند و این امر تحقق چنین رویکردی برای نابودی تومورهایی که در بیش از چند سانتیمتری پوست قرار دارند را غیر ممکن میکند.
دانشمندان دانشگاه استنفورد گامی مهم را در شیوه استفاده از میدانهای مغناطیسی برای کشتن تومورهای سرطانی برداشتند. از زمان ورود نانوفناوری ضد سرطان به حوزه پزشکی، محققان همواره درصدد استفاده از میدانهای مغناطیسی جهت افزایش تراکم نانو ذرات اکسید آهن سوار بر دارو در مسیر رسیدن به تومور بودهاند. با این حال میدانهای مغناطیسی با افزایش فاصله، سریعاً افت میکنند و این امر تحقق چنین رویکردی برای نابودی تومورهایی که در بیش از چند سانتیمتری پوست قرار دارند را غیر ممکن میکند. 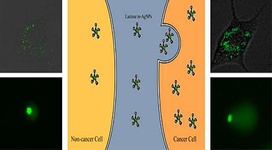 محققان ترکیهای به بررسی اثرات سمی نانوذرات نقره روی سلولهای انسانی و سلولهای سرطانی پرداختند. نانوذرات نقره به دلیل داشتن خواص آنتی باکتریال دارای کاربردهای زیادی در صنعت هستند. مقالات زیادی درباره آزاد شدن یون نقره و تاثیر منفی آن روی میکروارگانیسمها نظیر باکتریها، قارچها و جلبکها به چاپ رسیده است. در صورت رهاسازی پسابهای آلوده به محیط زیست، میکرواورگانیسمهای خاک نیز دچار آسیب میشوند. یک گروه تحقیقات بین المللی مقادیر نانوذرات نقره را در پسابها مورد بررسی قرار دادند. نتایج این پژوهش میتواند اطلاعات مفیدی درباره اثرات منفی نانوذرات موجود در پسابها روی محیط و انسان ارائه کند. وجود نانوذرات نقره حتی در مقادیر کم نیز میتواند روی ماهیها تاثیرگذار باشد.
محققان ترکیهای به بررسی اثرات سمی نانوذرات نقره روی سلولهای انسانی و سلولهای سرطانی پرداختند. نانوذرات نقره به دلیل داشتن خواص آنتی باکتریال دارای کاربردهای زیادی در صنعت هستند. مقالات زیادی درباره آزاد شدن یون نقره و تاثیر منفی آن روی میکروارگانیسمها نظیر باکتریها، قارچها و جلبکها به چاپ رسیده است. در صورت رهاسازی پسابهای آلوده به محیط زیست، میکرواورگانیسمهای خاک نیز دچار آسیب میشوند. یک گروه تحقیقات بین المللی مقادیر نانوذرات نقره را در پسابها مورد بررسی قرار دادند. نتایج این پژوهش میتواند اطلاعات مفیدی درباره اثرات منفی نانوذرات موجود در پسابها روی محیط و انسان ارائه کند. وجود نانوذرات نقره حتی در مقادیر کم نیز میتواند روی ماهیها تاثیرگذار باشد.  محققان آمريکايي با استفاده مواد پليمري موفق به توليد نانوذراتي مشابه پلاکت شدند. اين نانوذرات زمان بند آمدن خون را کاهش ميدهند. نانوذرات متصل به پلاکتهاي خوني ميتوانند لختههايي ايجاد کنند که احتمال زنده ماندن را در اولين ساعت پس از جراحت افزايش دهد. «ارين لاويک» از پژوهشگران دانشگاه کيس وسترن ويزرو و رهبر اين تيم تحقيقاتي ميگويد: ما ميدانيم که تزريق اين نانوذرات ميتواند فرايند خونريزي را به شدت کاهش دهد. با اين کار شانس زنده ماندن مجروح بيشتر ميشود.
محققان آمريکايي با استفاده مواد پليمري موفق به توليد نانوذراتي مشابه پلاکت شدند. اين نانوذرات زمان بند آمدن خون را کاهش ميدهند. نانوذرات متصل به پلاکتهاي خوني ميتوانند لختههايي ايجاد کنند که احتمال زنده ماندن را در اولين ساعت پس از جراحت افزايش دهد. «ارين لاويک» از پژوهشگران دانشگاه کيس وسترن ويزرو و رهبر اين تيم تحقيقاتي ميگويد: ما ميدانيم که تزريق اين نانوذرات ميتواند فرايند خونريزي را به شدت کاهش دهد. با اين کار شانس زنده ماندن مجروح بيشتر ميشود.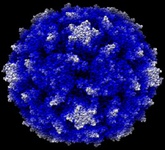 محققان دانشگاه نيويورک با افزودن کرههاي نانومقياس طلا روي يک دانه ميکروسکوپي شيشه، يک ابرحسگر ساختهاند که ميتواند حضور حتي نمونه منفرد از کوچکترين ويروسهاي شناخته شده را نيز تشخيص دهد. اين حسگر يک رفتار نوري بسيار عجيب از خود نشان ميدهد که به نام «حالت گالري نجوا» ناميده ميشود؛ اين نام از گالري دايرهاي معروف در کليساي بزرگ سنت پل در لندن گرفته شده است که در آن کوچکترين نجواي کنار ديوار را ميتوان در تمام نقاط اطراف گالري شنيد.
محققان دانشگاه نيويورک با افزودن کرههاي نانومقياس طلا روي يک دانه ميکروسکوپي شيشه، يک ابرحسگر ساختهاند که ميتواند حضور حتي نمونه منفرد از کوچکترين ويروسهاي شناخته شده را نيز تشخيص دهد. اين حسگر يک رفتار نوري بسيار عجيب از خود نشان ميدهد که به نام «حالت گالري نجوا» ناميده ميشود؛ اين نام از گالري دايرهاي معروف در کليساي بزرگ سنت پل در لندن گرفته شده است که در آن کوچکترين نجواي کنار ديوار را ميتوان در تمام نقاط اطراف گالري شنيد. گروهي از محققان چيني با استفاده از نانوسيمهاي سيليکوني يک ابزار بسيار حساس براي تشخيص ويروس آنفلوآنزا در بازدم انسان ساختهاند. آناليز ماده حاصل از ميعان بازدم (EBC) يکي از روشهاي تشخيصي نويدبخش است که ميتواند اجزاي گازي مختلف در بازدم انسان را به بيماريهاي مختلف ارتباط دهد. به علاوه، نمونهبرداري از بازدم سادهتر و سريعتر از تست خون است و هيچگونه ضايعات سمي توليد نميکند. نانوذرات طلا، نانولولههاي کربني و نانوسيمهاي سيليکوني جزء عناصري هستند که در تشخيص عاري از برچسب و بسيار حساس ويروسها به کار ميروند.
گروهي از محققان چيني با استفاده از نانوسيمهاي سيليکوني يک ابزار بسيار حساس براي تشخيص ويروس آنفلوآنزا در بازدم انسان ساختهاند. آناليز ماده حاصل از ميعان بازدم (EBC) يکي از روشهاي تشخيصي نويدبخش است که ميتواند اجزاي گازي مختلف در بازدم انسان را به بيماريهاي مختلف ارتباط دهد. به علاوه، نمونهبرداري از بازدم سادهتر و سريعتر از تست خون است و هيچگونه ضايعات سمي توليد نميکند. نانوذرات طلا، نانولولههاي کربني و نانوسيمهاي سيليکوني جزء عناصري هستند که در تشخيص عاري از برچسب و بسيار حساس ويروسها به کار ميروند.  مهندسان دانشگاه براون موفق به كنترل باكتري استافیلوکوکوس اورئوس با استفاده از نانوذرات سلنيوم شدند. سلنیوم یک عنصر ارزان است و بطور طبیعی به بدن تعلق دارد. اگرچه مشخص شده است که این عنصر به باکتریها حمله میکند، اما هنوز سلنیوم بعنوان روکش آنتیبیوتیک روی مواد افزاره پزشکی امتحان نشده است. مهندسان دانشگاه براون در یک مطالعه جدید گزارش کردهاند هنگامی که آنها از نانوذرات سلنیومی برای روکش پلیکربنات که ماده سازنده لولههای جراحی بولی و ریوی است، استفاده میکنند، کاهش زیادی در جمعیت باکتری استافیلوکوکوس آریوس کشت شده تا مقدار 90 درصد مشاهده میشود.
مهندسان دانشگاه براون موفق به كنترل باكتري استافیلوکوکوس اورئوس با استفاده از نانوذرات سلنيوم شدند. سلنیوم یک عنصر ارزان است و بطور طبیعی به بدن تعلق دارد. اگرچه مشخص شده است که این عنصر به باکتریها حمله میکند، اما هنوز سلنیوم بعنوان روکش آنتیبیوتیک روی مواد افزاره پزشکی امتحان نشده است. مهندسان دانشگاه براون در یک مطالعه جدید گزارش کردهاند هنگامی که آنها از نانوذرات سلنیومی برای روکش پلیکربنات که ماده سازنده لولههای جراحی بولی و ریوی است، استفاده میکنند، کاهش زیادی در جمعیت باکتری استافیلوکوکوس آریوس کشت شده تا مقدار 90 درصد مشاهده میشود.  محققان آمريکايي نانوذراتي توليد کردند که ميتواند سوپراکسيدهاي توليد شده در نتيجه جراحات مغزي را خنثي کند. با اين کار مجروحي که دچار عارض مغزي شده، شانس بيشتري براي زنده بودن خواهد داشت. دانشگاه رايس با همکاري محققاني از کالج پزشکي بيلور نانوذراتي ساختهاند که ميتواند براي درمان مجروحاني که دچار ضايعه مغزي شدند، مفيد باشد. اين نانوذرات از ترکيب خوشههاي کربني آبگريز با پلياتيلن گليکول (PEG-HCC) توليد شده است. در حال حاضر از اين ماده براي درمان سرطان استفاده ميشود که بعنوان آنتياکسيدان بکار گرفته ميشود.
محققان آمريکايي نانوذراتي توليد کردند که ميتواند سوپراکسيدهاي توليد شده در نتيجه جراحات مغزي را خنثي کند. با اين کار مجروحي که دچار عارض مغزي شده، شانس بيشتري براي زنده بودن خواهد داشت. دانشگاه رايس با همکاري محققاني از کالج پزشکي بيلور نانوذراتي ساختهاند که ميتواند براي درمان مجروحاني که دچار ضايعه مغزي شدند، مفيد باشد. اين نانوذرات از ترکيب خوشههاي کربني آبگريز با پلياتيلن گليکول (PEG-HCC) توليد شده است. در حال حاضر از اين ماده براي درمان سرطان استفاده ميشود که بعنوان آنتياکسيدان بکار گرفته ميشود.  مطالعهاي پيشباليني نشان داد: يک نانوذرهي آزادکننده اکسيد نيتريک (NO- NP) که قبلا خاصيت ضدباکتري آن براي باکتريهاي گرم مثبت و منفي و نيز خاصيت شتابدهي آن در بهبود زخمها در مدلهاي بريدگي حيواني مشاهده شده است، در زدودن عفونتهاي کانديدا (Candida) سوختگي در موشها موثر است. دکتر «لوئيس مارتينز»، استاديار علوم بيوپزشکي دانشگاه لانگ ايسلند، ميگويد: معلوم شده است که اکسيد نيتريک داراي فعاليت ضدقارچي مستقيم است، ميتواند پاسخهاي ايمني ميزبان را تعديل کند و نيز يک تنظيمکننده مهم براي شفاي زخم است. ما کار موفق قبلي خودمان را با استفاده از فناوري آزادکننده NO در بيماريزاهاي باکتريايي و زخمهاي جراحي به يک ارگانيسم جديد (کانديدا) و نيز يک مدل زخم جديد (سوختگي گرمايي با ضخامت کامل) توسعه داده و تاثير NO-np را بسيار موثر يافتيم.
مطالعهاي پيشباليني نشان داد: يک نانوذرهي آزادکننده اکسيد نيتريک (NO- NP) که قبلا خاصيت ضدباکتري آن براي باکتريهاي گرم مثبت و منفي و نيز خاصيت شتابدهي آن در بهبود زخمها در مدلهاي بريدگي حيواني مشاهده شده است، در زدودن عفونتهاي کانديدا (Candida) سوختگي در موشها موثر است. دکتر «لوئيس مارتينز»، استاديار علوم بيوپزشکي دانشگاه لانگ ايسلند، ميگويد: معلوم شده است که اکسيد نيتريک داراي فعاليت ضدقارچي مستقيم است، ميتواند پاسخهاي ايمني ميزبان را تعديل کند و نيز يک تنظيمکننده مهم براي شفاي زخم است. ما کار موفق قبلي خودمان را با استفاده از فناوري آزادکننده NO در بيماريزاهاي باکتريايي و زخمهاي جراحي به يک ارگانيسم جديد (کانديدا) و نيز يک مدل زخم جديد (سوختگي گرمايي با ضخامت کامل) توسعه داده و تاثير NO-np را بسيار موثر يافتيم. یک گروه پژوهشی از دانشگاه استنفورد با استفاده از نانوذراتی که میتوانند به سه فناوری مختلف تصویربرداری شوند، تومورهای مغزی موش را با یک دقت بیسابقه برداشتهاند. این گروه به رهبری «سانجیو سام گامبهیر» نشان داد که نانوذرات مهندسی شده بر روی تومورهای مغزی متمرکز شده و آنها را پررنگ میکنند و به دقت مرزهای آنها را مشخص کرده و برداشتن کامل آنها را تسهیل میكنند. با اصلاح بیشتر این نانوذرات میتوان در پیشبيني بیماری مانند سرطان مهلک مغز بهبود ایجاد کرد. عامل تصویربرداری که گروه استنفورد ابداع كرده است از یک هسته طلا تشکیل میشود که با یک عامل تصویربرداری رامان - یک لایه نازک از جنس سیليکای محافظتی- و یک پوشش اضافی از جنس گادولینیوم -عامل تباین تصویربرداری تشدید مغناطیسی(MIR)- پوشیده شده است.
یک گروه پژوهشی از دانشگاه استنفورد با استفاده از نانوذراتی که میتوانند به سه فناوری مختلف تصویربرداری شوند، تومورهای مغزی موش را با یک دقت بیسابقه برداشتهاند. این گروه به رهبری «سانجیو سام گامبهیر» نشان داد که نانوذرات مهندسی شده بر روی تومورهای مغزی متمرکز شده و آنها را پررنگ میکنند و به دقت مرزهای آنها را مشخص کرده و برداشتن کامل آنها را تسهیل میكنند. با اصلاح بیشتر این نانوذرات میتوان در پیشبيني بیماری مانند سرطان مهلک مغز بهبود ایجاد کرد. عامل تصویربرداری که گروه استنفورد ابداع كرده است از یک هسته طلا تشکیل میشود که با یک عامل تصویربرداری رامان - یک لایه نازک از جنس سیليکای محافظتی- و یک پوشش اضافی از جنس گادولینیوم -عامل تباین تصویربرداری تشدید مغناطیسی(MIR)- پوشیده شده است.  استفاده از پتانسيلهاي طبيعت، ايمنترين راه مبارزه با بيماري سرطان است. اخيرا محققان دانشگاه پليتکنيک هنگکنگ قدمهاي تازهاي در اين مسير برداشتهاند. آنها درصدد ساخت نانوذرات با استفاده از نوعي قارچ هستند که بتواند با تومورهاي سرطاني مقابله کند. سرطان واژهاي ترسناک براي بسيار از مردم است. برخي از انواع سرطانها کشنده بوده و درمان آنها دشوار است از سوي ديگر روشهاي درماني نظير شيمي درماني داراي عوارض جانبي و صدمات فيزيکي هستند بهطوري که تاثير منفي اين عوارض گاهي بيشتر از خود بيماري سرطان است. اگر داروهاي ضد سرطان ريشه در مواد طبيعي داشته باشند، چه اتفاقي خواهد افتاد؟ محققان معتقدند که چنين داروهايي ميتواند روش درمان ايمنتري نسبت به دارويها رايج باشد.
استفاده از پتانسيلهاي طبيعت، ايمنترين راه مبارزه با بيماري سرطان است. اخيرا محققان دانشگاه پليتکنيک هنگکنگ قدمهاي تازهاي در اين مسير برداشتهاند. آنها درصدد ساخت نانوذرات با استفاده از نوعي قارچ هستند که بتواند با تومورهاي سرطاني مقابله کند. سرطان واژهاي ترسناک براي بسيار از مردم است. برخي از انواع سرطانها کشنده بوده و درمان آنها دشوار است از سوي ديگر روشهاي درماني نظير شيمي درماني داراي عوارض جانبي و صدمات فيزيکي هستند بهطوري که تاثير منفي اين عوارض گاهي بيشتر از خود بيماري سرطان است. اگر داروهاي ضد سرطان ريشه در مواد طبيعي داشته باشند، چه اتفاقي خواهد افتاد؟ محققان معتقدند که چنين داروهايي ميتواند روش درمان ايمنتري نسبت به دارويها رايج باشد. مهندسان شیمی با استفاده از تکنیکی به نام «اوریگامی اسید نوکلئیک» ذرات ریزی از RNA و DNA ساختهاند که میتوانند پارههایی از RNA را مستقیما به تومورها تحویل داده و باعث خاموشی ژنهای بروز یافته در سلولهای سرطانی شوند. پژوهشگران توانستند با موفقیت از نانوذره ساخته شده از رشتههای دي.ان.اي و آر.ان.اي برای خاموش کردن ژن در سلولهای توموری استفاده کنند. بسیاری از پژوهشگران برای دستیابی به این نوع خاموشی ژنی که به تداخل RNA معروف است، سعی کردهاند از ذرات پلیمری یا لیپیدی برای تحویل RNA استفاده کنند. با این حال، «دانیال آندرسون» از موسسه فناوری ماساچوست (MIT) میگوید که ممکن است این نوع مواد برای سلامتی خطرناک باشند و هدفگیری آنها نیز سخت است.
مهندسان شیمی با استفاده از تکنیکی به نام «اوریگامی اسید نوکلئیک» ذرات ریزی از RNA و DNA ساختهاند که میتوانند پارههایی از RNA را مستقیما به تومورها تحویل داده و باعث خاموشی ژنهای بروز یافته در سلولهای سرطانی شوند. پژوهشگران توانستند با موفقیت از نانوذره ساخته شده از رشتههای دي.ان.اي و آر.ان.اي برای خاموش کردن ژن در سلولهای توموری استفاده کنند. بسیاری از پژوهشگران برای دستیابی به این نوع خاموشی ژنی که به تداخل RNA معروف است، سعی کردهاند از ذرات پلیمری یا لیپیدی برای تحویل RNA استفاده کنند. با این حال، «دانیال آندرسون» از موسسه فناوری ماساچوست (MIT) میگوید که ممکن است این نوع مواد برای سلامتی خطرناک باشند و هدفگیری آنها نیز سخت است.  دانشمندان دانشگاه 'ییل' موفق به كشف یك روش جدید فوق پیشرفته با استفاده از فناوری نانو برای درمان سرطان شدند. یكی از مهمترین عوامل بروز و گسترش سلول های سرطانی در بدن ضعف سیستم ایمنی است. مزیت درمان به این روش در مقایسه با روش های قبلی دارو رسانی به سلول های بیمار و تقویت سیستم ایمنی به طور همزمان است. یعنی علاوه بر این كه، دارو مستقیما به سلول بیمار تزریق می شود، سیستم ایمنی نیز تقویت شده و به این شكل روند بهبودی به میزان قابل توجهی افزایش می یابد. در این روش از كره های توخالی در مقیاس نانو برای انتقال دارو استفاده می شود و پیشرفته ترین روش در نوع خود است. محتویات موجود در این كره ها به دو قسمت تقسیم می شوند؛ یك بخش مربوط به تخریب سلول های سرطانی و بخش دیگر حاوی پروتئینی است كه سیستم ایمنی بدن را بهبود می دهد. متاسفانه باید گفت كه عامل اصلی بیماری سرطان و ام اس ضعف سیستم ایمنی بدن است، بنا براین پزشكان به افراد توصیه می كنند كه با انتخاب الگوی صحیح زندگی در حفظ سلامت خود دقت بیشتری داشته باشند.
دانشمندان دانشگاه 'ییل' موفق به كشف یك روش جدید فوق پیشرفته با استفاده از فناوری نانو برای درمان سرطان شدند. یكی از مهمترین عوامل بروز و گسترش سلول های سرطانی در بدن ضعف سیستم ایمنی است. مزیت درمان به این روش در مقایسه با روش های قبلی دارو رسانی به سلول های بیمار و تقویت سیستم ایمنی به طور همزمان است. یعنی علاوه بر این كه، دارو مستقیما به سلول بیمار تزریق می شود، سیستم ایمنی نیز تقویت شده و به این شكل روند بهبودی به میزان قابل توجهی افزایش می یابد. در این روش از كره های توخالی در مقیاس نانو برای انتقال دارو استفاده می شود و پیشرفته ترین روش در نوع خود است. محتویات موجود در این كره ها به دو قسمت تقسیم می شوند؛ یك بخش مربوط به تخریب سلول های سرطانی و بخش دیگر حاوی پروتئینی است كه سیستم ایمنی بدن را بهبود می دهد. متاسفانه باید گفت كه عامل اصلی بیماری سرطان و ام اس ضعف سیستم ایمنی بدن است، بنا براین پزشكان به افراد توصیه می كنند كه با انتخاب الگوی صحیح زندگی در حفظ سلامت خود دقت بیشتری داشته باشند. دانشمندان نوعي کپسول کوچک براي درمان بيماريها توليد کردهاند که حاوي دارو نيست، بلکه حاوي DNA و ماشينآلات زيستي ديگر براي توليد دارو هستند. اين محققان کپسولهاي جديدي در مقياس نانو و ميکرو طراحي کردهاند که حاوي راهنماييهاي کدشده ژنتيکي و خطوط توليد براي سنتز پروتئينها هستند؛ اين خطوط توليد را ميتوان با استفاده از يک سيگنال خارجي فعال کرد.
دانشمندان نوعي کپسول کوچک براي درمان بيماريها توليد کردهاند که حاوي دارو نيست، بلکه حاوي DNA و ماشينآلات زيستي ديگر براي توليد دارو هستند. اين محققان کپسولهاي جديدي در مقياس نانو و ميکرو طراحي کردهاند که حاوي راهنماييهاي کدشده ژنتيکي و خطوط توليد براي سنتز پروتئينها هستند؛ اين خطوط توليد را ميتوان با استفاده از يک سيگنال خارجي فعال کرد.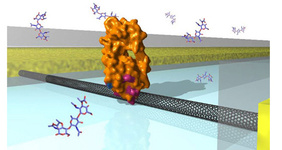 محققان در دانشگاه کاليفرنيا با متصل کردن يک آنزيم به يک نانولوله کربني، موفق به پايش جزئيات بيسابقهاي از رفتار آن شدهاند. اين تکنيک يک راه کاملا جديد براي مطالعه مولکولهاي زيستي است و ممکن است براي دستهاي از کاربردها در پزشکي مفيد باشد؛ بعضي از اين کاربردها شامل بررسي زيستمولکولهاي استفاده شده در بيماريهاي متنوع يا براي ساخت داروهاي جديد در آينده است.
محققان در دانشگاه کاليفرنيا با متصل کردن يک آنزيم به يک نانولوله کربني، موفق به پايش جزئيات بيسابقهاي از رفتار آن شدهاند. اين تکنيک يک راه کاملا جديد براي مطالعه مولکولهاي زيستي است و ممکن است براي دستهاي از کاربردها در پزشکي مفيد باشد؛ بعضي از اين کاربردها شامل بررسي زيستمولکولهاي استفاده شده در بيماريهاي متنوع يا براي ساخت داروهاي جديد در آينده است.  استفاده از امواج راديويي براي فعال کردن نانوذرات حاوي دارو يکي از راههاي درمان سرطان است. مشکل اين روش تمايل نانوذرات به متجمع شدن و کاهش کارايي اين روش است؛ اما اخيرا پژوهشگران با تغيير اسيديته سلول مانع از تجمع نانوذرات شدهاند. يکي از روشهاي درمان سرطان، استفاده از نانوذرات براي پختن تومورها است، اين روش داراي کمتري اثر جانبي است. اخيرا يک تيم تحقيقاتي از مرکز نانوپزشکي سرطان تگزاس نشان دادند که ميتوان از نانوذرات طلا براي درمان سرطان استفاده کرد. براي اين کار نانوذرات بوسيله امواج راديويي گرم شده که اين گرما موجب پختن سلولها ميشود. همچنين پژوهشگران دريافتند که چگونه ميتوان خاصيت سميت گرمايي اين نانوذرات را افزايش داد. اين تحقيقات توسط «استيون کرلي» از دانشگاه «تگزاس» و «لون ويلسون» از دانشگاه «رايس» انجام گرفته است. نتايج اين تحقيق در قالب مقالهاي تحت عنوان Stability of antibody-conjugated gold nanoparticles in the endo-lysosomal nanoenvironment: Implications for non-invasive radiofrequency-based Cancer therapy در نشريه «Nanomedicine» به چاپ رسيده است.
استفاده از امواج راديويي براي فعال کردن نانوذرات حاوي دارو يکي از راههاي درمان سرطان است. مشکل اين روش تمايل نانوذرات به متجمع شدن و کاهش کارايي اين روش است؛ اما اخيرا پژوهشگران با تغيير اسيديته سلول مانع از تجمع نانوذرات شدهاند. يکي از روشهاي درمان سرطان، استفاده از نانوذرات براي پختن تومورها است، اين روش داراي کمتري اثر جانبي است. اخيرا يک تيم تحقيقاتي از مرکز نانوپزشکي سرطان تگزاس نشان دادند که ميتوان از نانوذرات طلا براي درمان سرطان استفاده کرد. براي اين کار نانوذرات بوسيله امواج راديويي گرم شده که اين گرما موجب پختن سلولها ميشود. همچنين پژوهشگران دريافتند که چگونه ميتوان خاصيت سميت گرمايي اين نانوذرات را افزايش داد. اين تحقيقات توسط «استيون کرلي» از دانشگاه «تگزاس» و «لون ويلسون» از دانشگاه «رايس» انجام گرفته است. نتايج اين تحقيق در قالب مقالهاي تحت عنوان Stability of antibody-conjugated gold nanoparticles in the endo-lysosomal nanoenvironment: Implications for non-invasive radiofrequency-based Cancer therapy در نشريه «Nanomedicine» به چاپ رسيده است. 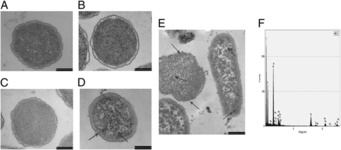 مطالعات محققان چيني بر روي تاثير نانومواد بر باکتريها نشان ميدهد نانومواد ميتواند مقاومت باکتريها را در برابر آنتي بيوتيک افزايش دهد. نبرد ميان توليد آنتيبيوتيکها و باکتريها همچنان ادامه دارد. باکتريها به سرعت ميتوانند تغيير کرده و از نظر ژنتيکي خود را با داروهاي آنتيبيوتيک وفق دهند. اين کار از طريق انتقال ژن در هم آميختگي انجام ميشود. اين روند ميتواند در سطح جهاني اتفاق افتاده و در نهايت موجب پديدار شدن گونهاي از باکتريها به نام ابرباکتري شود که نسبت به بسياري از داروها از ايمني برخوردار هستند.
مطالعات محققان چيني بر روي تاثير نانومواد بر باکتريها نشان ميدهد نانومواد ميتواند مقاومت باکتريها را در برابر آنتي بيوتيک افزايش دهد. نبرد ميان توليد آنتيبيوتيکها و باکتريها همچنان ادامه دارد. باکتريها به سرعت ميتوانند تغيير کرده و از نظر ژنتيکي خود را با داروهاي آنتيبيوتيک وفق دهند. اين کار از طريق انتقال ژن در هم آميختگي انجام ميشود. اين روند ميتواند در سطح جهاني اتفاق افتاده و در نهايت موجب پديدار شدن گونهاي از باکتريها به نام ابرباکتري شود که نسبت به بسياري از داروها از ايمني برخوردار هستند.  محققان موفق به توليد نانولولههاي جديد براي تصويربرداري و دارورساني شدند. ميتوان از نانولولههاي کربني براي نفوذ بيخطر به درون سلولهاي انسان و رهايش داروهاي ضد سرطان يا مولکولهاي DNA تغييريافته در ژندرماني استفاده کرد. با وجودي که هنوز راهي طولاني تا استفاده از اين فناوري در کاربردهاي باليني بايد طي شود، گروهي از محققان دانشگاه «بث» به رهبري دکتر «صوفيا پاسکو» نشان دادهاند که چگونه اين لولهها ميتوانند به عنوان «حاملهاي بار» عمل کرده و با نفوذ در غشاي بيروني سلول، برخي مولکولهاي دارويي را به درون سلول برسانند.
محققان موفق به توليد نانولولههاي جديد براي تصويربرداري و دارورساني شدند. ميتوان از نانولولههاي کربني براي نفوذ بيخطر به درون سلولهاي انسان و رهايش داروهاي ضد سرطان يا مولکولهاي DNA تغييريافته در ژندرماني استفاده کرد. با وجودي که هنوز راهي طولاني تا استفاده از اين فناوري در کاربردهاي باليني بايد طي شود، گروهي از محققان دانشگاه «بث» به رهبري دکتر «صوفيا پاسکو» نشان دادهاند که چگونه اين لولهها ميتوانند به عنوان «حاملهاي بار» عمل کرده و با نفوذ در غشاي بيروني سلول، برخي مولکولهاي دارويي را به درون سلول برسانند.  محققان به فناوری جدیدی دست یافته اند كه می تواند داروها را مستقیم به دورن سلول ها وارد كند. دانشمندان دانشگاه بارسلونا در اسپانیا می گویند این ابزار موسوم به ' باكتری های حامل' است كه در واقع محلول پایدار نانوذرات است كه معمولا در باكتری های نوتركیب وجوددارند. حتی اگر، این باكتری های حامل كه به طور سنتی برای تولید صنعتی آنزیم های پایدار و زیست داروها مانعی داشته اند اخیرا مشخص شده است كه همین باكتری های حامل ارزش زیادی در انتقال پروتئین های عملكردی با ارزش های مستقیم در كابردهای زیست پزشكی و صنعتی دارند. این پژوهشگران ارزش این نانوذرات را به عنوان 'نانوقرص'های طبیعی با ظرفیت قوی برای نفوذ به سلول ها و انجانم فعالیت های زیست شناختی مورد بررسی قرار دادند. مفهوم نانوقرص در واقع نشان دهنده زمینه جدید و امیدوار كننده ای برای تجویز دارو است. این نانوقرصهاهمچنین حاكی از توانایی بالقوه مواد میكروبی در پزشكی است كه باید مورد بررسی و كاورش بیشتری قرار گیرند.
محققان به فناوری جدیدی دست یافته اند كه می تواند داروها را مستقیم به دورن سلول ها وارد كند. دانشمندان دانشگاه بارسلونا در اسپانیا می گویند این ابزار موسوم به ' باكتری های حامل' است كه در واقع محلول پایدار نانوذرات است كه معمولا در باكتری های نوتركیب وجوددارند. حتی اگر، این باكتری های حامل كه به طور سنتی برای تولید صنعتی آنزیم های پایدار و زیست داروها مانعی داشته اند اخیرا مشخص شده است كه همین باكتری های حامل ارزش زیادی در انتقال پروتئین های عملكردی با ارزش های مستقیم در كابردهای زیست پزشكی و صنعتی دارند. این پژوهشگران ارزش این نانوذرات را به عنوان 'نانوقرص'های طبیعی با ظرفیت قوی برای نفوذ به سلول ها و انجانم فعالیت های زیست شناختی مورد بررسی قرار دادند. مفهوم نانوقرص در واقع نشان دهنده زمینه جدید و امیدوار كننده ای برای تجویز دارو است. این نانوقرصهاهمچنین حاكی از توانایی بالقوه مواد میكروبی در پزشكی است كه باید مورد بررسی و كاورش بیشتری قرار گیرند.