..:::: درمان بیماریهای عصبی با سلولهای فضولات انسانی ::::..
 استفاده از فضولات انسانی به عنوان منبع غنی تامین سلول های مورد نیاز در مطالعات پزشکی، می تواند برخی از مشکلات استفاده از سلول های بنیادی را برطرف کند. برخی از فضولاتی که انسان هر روزه دفع میکند، می تواند به عنوان منبعی برای تامین سلولهایی مورد استفاده قرار گیرد که در مطالعه بیماریها به کار می روند و حتی این امید وجود دارد که سلول های به دست آمده از این روش روزی برای درمان بیماری های تخریب کننده عصبی به کار گرفته شوند.
استفاده از فضولات انسانی به عنوان منبع غنی تامین سلول های مورد نیاز در مطالعات پزشکی، می تواند برخی از مشکلات استفاده از سلول های بنیادی را برطرف کند. برخی از فضولاتی که انسان هر روزه دفع میکند، می تواند به عنوان منبعی برای تامین سلولهایی مورد استفاده قرار گیرد که در مطالعه بیماریها به کار می روند و حتی این امید وجود دارد که سلول های به دست آمده از این روش روزی برای درمان بیماری های تخریب کننده عصبی به کار گرفته شوند.
یک گروه تحقیقاتی به سرپرستی دوانگینگ پی، در موسسه درمان و سلامت گوانگژوی چین، اخیرا روشی را ابداع کرده است که به کمک آن می توان بدون استفاده از سلول های بنیادی و تنها با استخراج سلول های به جای مانده در فضولات انسانی و تبدیل آنها به سلول های پیش ساز نورونی، بخشی از مشکلات مطالعه بیماری های عصبی به کمک سلول های بنیادی، همچون خطر توموری شدن سلول ها پس از پیوند، را مرتفع کرد. سلول های پیش سازی که به کمک این روش تهیه می شوند این امکان را در اختیار پژوهشگران قرار می دهند تا با سرعت و حجم بیشتری نسبت به روش های فعلی، سلولهای مناسب را برای بیماران خود فراهم کنند.
در روش های متداول فعلی غالبا سلول های پوستی و خونی به کمک انتقال ژن های خاص و برنامه ریزی مجدد ژنوم آنها، به سلول های پر توان القایی یا سلول های iPS تبدیل شده و در ادامه سلول های iPS می توانند به سایر سلول های بدن تمایز یابند. در مقایسه روش های فعلی، استفاده از فضولات انسانی به عنوان منبع سلولی، منبع قابل دسترستری محسوب میشود. دیگر مزیت این روش عدم استفاده از رترو ویروس ها برای انتقال ژن های القا کننده ویژگی پر توانی به سلول های هدف است؛ چرا که استفاده از رترو ویروس ها می تواند به تغییرات شدید در ساختار ژنتیکی سلول ها و در نتیجه کاهش میزان پیش بینی پذیری سلول ها منجر شود. در مقابل گروه پی و همکارانش برای انتقال ژن ها از وکتورهایی بهره بردند که به ژنوم سلول میزبان وارد نمی شوند. نتایج مطالعات این گروه حاکی از آن است که سلول ها در این روش در مدت زمانی تقریبا نصف روش های متداول امروزی به سلول های iPS تبدیل میشوند. بر اساس نتایج اعلام شده از سوی این گروه تحقیقاتی سلول های پیش ساز پس از انتقال به محیط کشت مناسب به سلول های نورونی تمایز یافته و پس از پیوند به مغز مدل موشی نیز شواهد از ایجاد تومور مشاهده نشده است.
جیمزی الیس، پژوهشگر ژنتیک پزشکی در بیمارستان کودکان تورنتو در اونتاریوی کانادا که سلولهای iPS مختص هر بیمار را برای بررسی اختلالهای طیف اوتیسم تولید میکند، میگوید: "این امر میتواند به طور قطع سرعت کارها را بالا ببرد." به گفته مارک لیلاند، محقق مرکز سلامت دانشگاه کانتیکات در فارمینگتون کانادا، فایده تهیه سلولها به این شیوه این است که ادرار را میتوان از تقریبا همه بیماران گرفت. به ویژه اینکه اگر بخواهیم از کودکان نمونه برداری کنیم گرفتن نمونه ادرار بسیار سادهتر از واداشتن آنها به دادن نمونه خون است."
 محققان به تازگی دریافتهاند که با ایجاد تحریکات کوچک با استفاده از نور لیزر در بخشهایی از مغز موشها، میتوان علائم افسردگی را در این موشها فعال یا غیرفعال کرد. این موضوع پزشکان را به امکان درمان افسردگی در انسان با استفاده از روشهای مشابه امیدوار کرده است. نشانههای افسردگی در موشها را میتوان با روشن یا خاموش کردن یک کلید محرک فعال و غیرفعال کرد. مطالعات جدید نشان میدهند که فعال کردن یا خاموش کردن رفتار برخی سلولهای مغز با استفاده از نور لیزر باعث تغییر رفتارهای ناشی از افسردگی در حیوانات میشود.
محققان به تازگی دریافتهاند که با ایجاد تحریکات کوچک با استفاده از نور لیزر در بخشهایی از مغز موشها، میتوان علائم افسردگی را در این موشها فعال یا غیرفعال کرد. این موضوع پزشکان را به امکان درمان افسردگی در انسان با استفاده از روشهای مشابه امیدوار کرده است. نشانههای افسردگی در موشها را میتوان با روشن یا خاموش کردن یک کلید محرک فعال و غیرفعال کرد. مطالعات جدید نشان میدهند که فعال کردن یا خاموش کردن رفتار برخی سلولهای مغز با استفاده از نور لیزر باعث تغییر رفتارهای ناشی از افسردگی در حیوانات میشود. محققان دریافتند که استفاده از یک محصول تولید شده در جلبکهای دریایی به بهبود سکتههای مغزی کمک میکند. تایج یک تحقیق توسط محققان دانشگاه ویلمینگتون در کارولینای شمالی نشان میدهد که استفاده از ترکیب بروه توکسین – 2 (Brevetoxin-2) که بهطور طبیعی در جلبکهای دریایی تولید میشود توانست موجب رشد و افزایش انعطافپذیری سلولهای عصبی کشت داده شده موشهای آزمایشگاهی شود. نتایج حاصل از این تحقیق، افزایش جوانههای عصبی و شکلگیری سیناپس جدید بین سلولهای عصبی را در سلولهای عصبی این موشهای مورد مطالعه نشان میدهد.
محققان دریافتند که استفاده از یک محصول تولید شده در جلبکهای دریایی به بهبود سکتههای مغزی کمک میکند. تایج یک تحقیق توسط محققان دانشگاه ویلمینگتون در کارولینای شمالی نشان میدهد که استفاده از ترکیب بروه توکسین – 2 (Brevetoxin-2) که بهطور طبیعی در جلبکهای دریایی تولید میشود توانست موجب رشد و افزایش انعطافپذیری سلولهای عصبی کشت داده شده موشهای آزمایشگاهی شود. نتایج حاصل از این تحقیق، افزایش جوانههای عصبی و شکلگیری سیناپس جدید بین سلولهای عصبی را در سلولهای عصبی این موشهای مورد مطالعه نشان میدهد.  دانشمندان تایوانی و امریکایی با استفاده از فاکتور رشد اندوتلیال عروقی (VEGF) که باعث افزایش رشد مجدد عروق خونی میشود، موفق به یافتن درمانی امیدوارکننده برای حملات قلبی شدند. طی تلاشهای پیشین، استفاده از فاکتور رشد اندوتلیال عروقی در درمان بیماریهای قلبی با محدودیتهایی مواجه بود؛ جریان خون باعث میشد که فاکتور رشد اندوتلیال عروقی مورد نیاز از قلب خارج شود. اما نتایج این پژوهش جدید، مشکل ذکر شده را برطرف کرده است.
دانشمندان تایوانی و امریکایی با استفاده از فاکتور رشد اندوتلیال عروقی (VEGF) که باعث افزایش رشد مجدد عروق خونی میشود، موفق به یافتن درمانی امیدوارکننده برای حملات قلبی شدند. طی تلاشهای پیشین، استفاده از فاکتور رشد اندوتلیال عروقی در درمان بیماریهای قلبی با محدودیتهایی مواجه بود؛ جریان خون باعث میشد که فاکتور رشد اندوتلیال عروقی مورد نیاز از قلب خارج شود. اما نتایج این پژوهش جدید، مشکل ذکر شده را برطرف کرده است.  پژوهش محققان برزیلی نشان میدهد که زهر مار میتواند در مبارزه با سرطان پوست بسیار موثر واقع شود. محققان موسسه علمی «بوتان تان» برزیل طی گزارشی اعلام کردند پروتئین «کروماتین» که از زهر مار به دست میآید، میزان بقای موشهای مبتلا به سرطان پوست را 70 درصد افزایش میدهد. علاوه بر این، پروتئین مذکور به طور قابل توجهی گسترش تومورها را به تاخیر انداخته و حتی به طور کامل از تشکیل آنها جلوگیری میکند. محققان، طی این پژوهش بی سابقه همچنین کشف کردند که فعالیتهای سمی «کروماتین» در کشتن سلولها تنها منحصر به سلولهای ملانوم است و هیچ گونه آسیبی را به سایر سلولهای جاندار نمیرساند. گذشته از این، کروماتین تنها به مدت 24 ساعت در تومور سرطانی باقی میماند. پژوهشگران اظهار کردهاند که پیش از هرگونه اندیشه در رابطه با تولید دارویی جدید، باید آزمایشات دیگری روی سایر حیوانات و در نهایت بر سلولهای انسانی صورت گیرد. گرچه بنا بر این گزارش، پیش از انجام هر گونه آزمایش بر روی انسان، اولویت با سنتز و تولید کردن این پروتئین در محیط آزمایشگاه است، بدون این که زهر مار واقعی را مورد استفاده قرار دهیم.
پژوهش محققان برزیلی نشان میدهد که زهر مار میتواند در مبارزه با سرطان پوست بسیار موثر واقع شود. محققان موسسه علمی «بوتان تان» برزیل طی گزارشی اعلام کردند پروتئین «کروماتین» که از زهر مار به دست میآید، میزان بقای موشهای مبتلا به سرطان پوست را 70 درصد افزایش میدهد. علاوه بر این، پروتئین مذکور به طور قابل توجهی گسترش تومورها را به تاخیر انداخته و حتی به طور کامل از تشکیل آنها جلوگیری میکند. محققان، طی این پژوهش بی سابقه همچنین کشف کردند که فعالیتهای سمی «کروماتین» در کشتن سلولها تنها منحصر به سلولهای ملانوم است و هیچ گونه آسیبی را به سایر سلولهای جاندار نمیرساند. گذشته از این، کروماتین تنها به مدت 24 ساعت در تومور سرطانی باقی میماند. پژوهشگران اظهار کردهاند که پیش از هرگونه اندیشه در رابطه با تولید دارویی جدید، باید آزمایشات دیگری روی سایر حیوانات و در نهایت بر سلولهای انسانی صورت گیرد. گرچه بنا بر این گزارش، پیش از انجام هر گونه آزمایش بر روی انسان، اولویت با سنتز و تولید کردن این پروتئین در محیط آزمایشگاه است، بدون این که زهر مار واقعی را مورد استفاده قرار دهیم. شيوه ابداعي محققان دانشگاه شفيلد در فرآيند رمزگشايي از پروتئين TREX مي تواند نويد دهنده درمان هاي جديد براي طيف گسترده اي از بيماري هاي مزمن از جمله انواع مختلف سرطان باشد. محققان دپارتمان بيوتكنولوژي و زيست شناسي مولكولي دانشگاه شفيلد با همكاري محققان دانشكده پزشكي هاروارد در تحقيقات خود نشان دادند كه چگونه مجموعه پيچيده اي از پروتئين هاي موسوم به TREX به عنوان كليدي براي انتقال نقشه هاي سلول براي توليد پروتئين هاي حياتي بدن عمل مي كنند. محققان معتقدند كه درك بهتر اين عملكرد به معني حل قطعي مشكل در فرآيندي است كه باعث بروز بيماري هاي مختلف مانند نورون حركتي، ديستروفي عضلاني و انواع مختلف سرطان مي شود.
شيوه ابداعي محققان دانشگاه شفيلد در فرآيند رمزگشايي از پروتئين TREX مي تواند نويد دهنده درمان هاي جديد براي طيف گسترده اي از بيماري هاي مزمن از جمله انواع مختلف سرطان باشد. محققان دپارتمان بيوتكنولوژي و زيست شناسي مولكولي دانشگاه شفيلد با همكاري محققان دانشكده پزشكي هاروارد در تحقيقات خود نشان دادند كه چگونه مجموعه پيچيده اي از پروتئين هاي موسوم به TREX به عنوان كليدي براي انتقال نقشه هاي سلول براي توليد پروتئين هاي حياتي بدن عمل مي كنند. محققان معتقدند كه درك بهتر اين عملكرد به معني حل قطعي مشكل در فرآيندي است كه باعث بروز بيماري هاي مختلف مانند نورون حركتي، ديستروفي عضلاني و انواع مختلف سرطان مي شود.  یک جعبه بسیار کوچک که در نشیمنگاه بدن کاشته میشود، میتواند بعنوان روش جدید درمان نارسایی قلبی مورد استفاده قرار گیرد. حدود 30 درصد از نارسایی های قلبی در اثر آسیب عضله قلب در زمان بروز حمله قلبی ایجاد میشود که باعث تضعیف عملکرد عضلات بطن چپ شده و فشار زیادی برای پمپاژ خون به قلب وارد کرده و در نتیجه قلب بزرگ تر و ضعیف تر میشود. تحقیقات نشان میدهد، تحریکات متناوب و 24 ساعته ستون فقرات و نخاع میتواند عملکرد بطن چپ به عنوان مسؤول اصلی پمپاژ خون در قلب را بطور چشمگیری بهبود داده و از بروز نارسایی قلبی پیشگیری کند.
یک جعبه بسیار کوچک که در نشیمنگاه بدن کاشته میشود، میتواند بعنوان روش جدید درمان نارسایی قلبی مورد استفاده قرار گیرد. حدود 30 درصد از نارسایی های قلبی در اثر آسیب عضله قلب در زمان بروز حمله قلبی ایجاد میشود که باعث تضعیف عملکرد عضلات بطن چپ شده و فشار زیادی برای پمپاژ خون به قلب وارد کرده و در نتیجه قلب بزرگ تر و ضعیف تر میشود. تحقیقات نشان میدهد، تحریکات متناوب و 24 ساعته ستون فقرات و نخاع میتواند عملکرد بطن چپ به عنوان مسؤول اصلی پمپاژ خون در قلب را بطور چشمگیری بهبود داده و از بروز نارسایی قلبی پیشگیری کند.  محققان با استفاده از نانوذرات طلا و ترکيبي که در برگ چاي يافت ميشود، موفق به ابداع روش موثرتري براي هدفگيري تومورهاي سرطان پروستات شدند. در حال حاضر براي درمان برخي از انواع سرطانها بايد از دوزهاي بالايي از داروهاي شيميدرماني استفاده شود که اين امر اثرات جانبي شديدي در پي دارد. حال محققان دانشگاه ميسوري با استفاده از نانوذرات طلا و ترکيبي که در برگ چاي يافت ميشود، روش موثرتري براي هدفگيري تومورهاي سرطان پروستات ابداع کردهاند. با استفاده از اين روش جديد دوز بسيار پاييني از داروهاي شيميدرماني نياز است و اين داروها در تمام بدن جاري نشده و در نتيجه به بافتهاي سالم آسيبي نميرسانند.
محققان با استفاده از نانوذرات طلا و ترکيبي که در برگ چاي يافت ميشود، موفق به ابداع روش موثرتري براي هدفگيري تومورهاي سرطان پروستات شدند. در حال حاضر براي درمان برخي از انواع سرطانها بايد از دوزهاي بالايي از داروهاي شيميدرماني استفاده شود که اين امر اثرات جانبي شديدي در پي دارد. حال محققان دانشگاه ميسوري با استفاده از نانوذرات طلا و ترکيبي که در برگ چاي يافت ميشود، روش موثرتري براي هدفگيري تومورهاي سرطان پروستات ابداع کردهاند. با استفاده از اين روش جديد دوز بسيار پاييني از داروهاي شيميدرماني نياز است و اين داروها در تمام بدن جاري نشده و در نتيجه به بافتهاي سالم آسيبي نميرسانند. 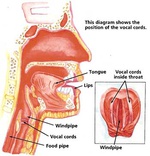 محققان مؤسسه تكنولوژي ماساچوست (MIT) موفق به ابداع تكنيك جديدي براي بازسازي و ترميم تارهاي صوتي آسيب ديده شدند. تارهاي صوتي بايد از قابليت ارتجاعي بالايي برخوردار باشند تا امكان هزاران بار ارتعاش در دقيقه و توليد صدا فراهم شود. تيم تحقيقاتي به سرپرستي پروفسور «رابرت لانگر» و دكتر «استيون سيتلس» در حال توسعه ژل جادويي هستند كه قابليت ارتجاعي را به تارهاي صوتي آسيب ديده باز مي گرداند.
محققان مؤسسه تكنولوژي ماساچوست (MIT) موفق به ابداع تكنيك جديدي براي بازسازي و ترميم تارهاي صوتي آسيب ديده شدند. تارهاي صوتي بايد از قابليت ارتجاعي بالايي برخوردار باشند تا امكان هزاران بار ارتعاش در دقيقه و توليد صدا فراهم شود. تيم تحقيقاتي به سرپرستي پروفسور «رابرت لانگر» و دكتر «استيون سيتلس» در حال توسعه ژل جادويي هستند كه قابليت ارتجاعي را به تارهاي صوتي آسيب ديده باز مي گرداند.  پژوهشگران دانشگاه سيدني استراليا موفق به ساخت نانوذراتي شدند که احتمالا ميتواند در درمان سرطان ريه مفيد باشد. اين گروه تحقيقاتي در تازهترين مطالعات خود نانوذراتي توليد کردهاند که به تومورها حمله ميکند و در عين حال آسيبي به سلولهاي سالم نميرساند؛ بنابراين در درمان سرطان کمترين اثرات جانبي را خواهد داشت. درون اين نانوذرات از چربيهايي پر شده است که در صورت قرار گرفتن در ميدان مغناطيسي فعال ميشوند.
پژوهشگران دانشگاه سيدني استراليا موفق به ساخت نانوذراتي شدند که احتمالا ميتواند در درمان سرطان ريه مفيد باشد. اين گروه تحقيقاتي در تازهترين مطالعات خود نانوذراتي توليد کردهاند که به تومورها حمله ميکند و در عين حال آسيبي به سلولهاي سالم نميرساند؛ بنابراين در درمان سرطان کمترين اثرات جانبي را خواهد داشت. درون اين نانوذرات از چربيهايي پر شده است که در صورت قرار گرفتن در ميدان مغناطيسي فعال ميشوند.  محققان موفق به شناسایی نوعی پروتئین شدند که میتواند منجر به بهبود یادگیری و حافظه در افراد شود. محققان دانشگاه لیدز با انجام مطالعات خود دریافتند پروتئینی به نام "پرایون" میتواند به مغز انسان در جذب "روی" کمک کند که تصور میشود این پدیده در افزایش توانایی افراد برای یادگیری و سلامتی حافظه بسیار مؤثر باشد. این محققان با اشاره به نتایج تحقیقات خود اظهار کردند: سطح مقادیر "روی" در میان سلولهای مغز با بروز بیماریهایی مانند آلزایمر و پارکینسون مرتبط است و با توجه به این که با بالا رفتن سن، سطح پروتئین "پرایون" در مغز کاهش مییابد و متعاقباً "روی" کمتری جذب میشود، این امر میتواند توضیح دهد که چرا قابلیتهای حافظه و یادگیری ما با افزایش سن کمتر میشود.
محققان موفق به شناسایی نوعی پروتئین شدند که میتواند منجر به بهبود یادگیری و حافظه در افراد شود. محققان دانشگاه لیدز با انجام مطالعات خود دریافتند پروتئینی به نام "پرایون" میتواند به مغز انسان در جذب "روی" کمک کند که تصور میشود این پدیده در افزایش توانایی افراد برای یادگیری و سلامتی حافظه بسیار مؤثر باشد. این محققان با اشاره به نتایج تحقیقات خود اظهار کردند: سطح مقادیر "روی" در میان سلولهای مغز با بروز بیماریهایی مانند آلزایمر و پارکینسون مرتبط است و با توجه به این که با بالا رفتن سن، سطح پروتئین "پرایون" در مغز کاهش مییابد و متعاقباً "روی" کمتری جذب میشود، این امر میتواند توضیح دهد که چرا قابلیتهای حافظه و یادگیری ما با افزایش سن کمتر میشود.  دانــشـمـنــدان بــه ايــن نـتـيـجــه رسـيــده انــد كــه تحريك مغزي ميتواند بـه درمـان چـاقـي كمك كـند.Dr Alexander بيان داشــــــت كــــــه در حـــــال حاضر DBS، درمان موفقيتآميزي براي بيماري پــاركـيـنـســون اســت.بــه عــلاوه مـيتـوانـد بـه طـور بالقوهاي براي درمان چاقي به كار رود كه البته اين كار با تحريك الكتريكي مغز انجام ميشود. در حال حاضر تعداد زيادي از افراد در دنيا از چاقي رنج ميبرند، ولي هنوز هيچ درماني براي آن شناخته نشده است.معمولا بسياري از افراد بعد از درمـــان چـــاق مــيشــونــد و بــا تــوجــه بــه ايــن كــه روشهاي بسياريبراي كاهش وزن وجود دارد. بـا ايـن حـال گـاهـي اوقـات موادي به بازار عرضه ميشود كه براي كنترل چاقي است ولي ضروري نيست. به علاوه اگر چه جراحي براي لاغري و تعداد زيادي از افراد نتيجه مثبت داشته ولي هنوز در بعضي از افراد بي نتيجه است.البته با كمك كنترل اشتها و وزن بدن ميتواند چاقي را كنترل كند. با توجه به نتيجه تحقيقات در دنيا ميدانيم كه مركز اشتها در هيپوتالاموس مغز قرار دارد و مغز با ترشح دو هورمون isuline و Leptin اشتها را تنظيم ميكند و در گذشته استفاده ازDBS چاقي درمان ميشد، بدين ترتيب كه مستقيم به هيپوتالاموس فـرستـاده مـيشـد. هـم اكنون روشهاي جديدي براي استفاده از DBS براي درمان به كار ميرود.
دانــشـمـنــدان بــه ايــن نـتـيـجــه رسـيــده انــد كــه تحريك مغزي ميتواند بـه درمـان چـاقـي كمك كـند.Dr Alexander بيان داشــــــت كــــــه در حـــــال حاضر DBS، درمان موفقيتآميزي براي بيماري پــاركـيـنـســون اســت.بــه عــلاوه مـيتـوانـد بـه طـور بالقوهاي براي درمان چاقي به كار رود كه البته اين كار با تحريك الكتريكي مغز انجام ميشود. در حال حاضر تعداد زيادي از افراد در دنيا از چاقي رنج ميبرند، ولي هنوز هيچ درماني براي آن شناخته نشده است.معمولا بسياري از افراد بعد از درمـــان چـــاق مــيشــونــد و بــا تــوجــه بــه ايــن كــه روشهاي بسياريبراي كاهش وزن وجود دارد. بـا ايـن حـال گـاهـي اوقـات موادي به بازار عرضه ميشود كه براي كنترل چاقي است ولي ضروري نيست. به علاوه اگر چه جراحي براي لاغري و تعداد زيادي از افراد نتيجه مثبت داشته ولي هنوز در بعضي از افراد بي نتيجه است.البته با كمك كنترل اشتها و وزن بدن ميتواند چاقي را كنترل كند. با توجه به نتيجه تحقيقات در دنيا ميدانيم كه مركز اشتها در هيپوتالاموس مغز قرار دارد و مغز با ترشح دو هورمون isuline و Leptin اشتها را تنظيم ميكند و در گذشته استفاده ازDBS چاقي درمان ميشد، بدين ترتيب كه مستقيم به هيپوتالاموس فـرستـاده مـيشـد. هـم اكنون روشهاي جديدي براي استفاده از DBS براي درمان به كار ميرود. اخيرا پژوهشگران آمريکايي روشي براي شيميدرماني يافتهاند که در آن به سلولهاي سالم آسيبي نميرسد. در اين روش به داروهاي شيميدرماني آنتي باديهايي متصل ميشود که به پروتئينهاي توليد شده توسط سلولهاي سرطاني ميچسبد. يک آنزيم براي فعال شدن دارو در اين کمپلکس قرار داده ميشود. پژوهشگران مرکز جان هاپکينز ميگويند: موفق به ارائه روشي شدند که با استفاده از آن ميتوان سلولهاي سرطان پروستات را شناسايي كرد و از بين برد به طوري که به سلولهاي سالم گزندي نرسد. اين روش به تصويربرداري ترانوستيک شهرت يافته است که ميتواند داروها را درون بدن رهگيري کرده و آنها را به سلول سرطاني برساند. اين روش مبتني بر اتصال يک نوع داروي شيميدرماني به پروتئين است، پروتئيني که به صورت اختصاصي به سطح سلولهاي سرطاني ميچسبد و موجب اتصال دارو به تومور ميشود. به اين کمپلکس داروي شيمي درماني و پروتئين، يک آنزيم هم متصل است. پس از اين که کمپلکس مورد نظر به سطح سلول چسبيد، وارد آن ميشود و در نهايت آنزيم موجب فعال شدن داروي ضد سرطان ميشود.
اخيرا پژوهشگران آمريکايي روشي براي شيميدرماني يافتهاند که در آن به سلولهاي سالم آسيبي نميرسد. در اين روش به داروهاي شيميدرماني آنتي باديهايي متصل ميشود که به پروتئينهاي توليد شده توسط سلولهاي سرطاني ميچسبد. يک آنزيم براي فعال شدن دارو در اين کمپلکس قرار داده ميشود. پژوهشگران مرکز جان هاپکينز ميگويند: موفق به ارائه روشي شدند که با استفاده از آن ميتوان سلولهاي سرطان پروستات را شناسايي كرد و از بين برد به طوري که به سلولهاي سالم گزندي نرسد. اين روش به تصويربرداري ترانوستيک شهرت يافته است که ميتواند داروها را درون بدن رهگيري کرده و آنها را به سلول سرطاني برساند. اين روش مبتني بر اتصال يک نوع داروي شيميدرماني به پروتئين است، پروتئيني که به صورت اختصاصي به سطح سلولهاي سرطاني ميچسبد و موجب اتصال دارو به تومور ميشود. به اين کمپلکس داروي شيمي درماني و پروتئين، يک آنزيم هم متصل است. پس از اين که کمپلکس مورد نظر به سطح سلول چسبيد، وارد آن ميشود و در نهايت آنزيم موجب فعال شدن داروي ضد سرطان ميشود.  دانشمندان نوعي کپسول کوچک براي درمان بيماريها توليد کردهاند که حاوي دارو نيست، بلکه حاوي DNA و ماشينآلات زيستي ديگر براي توليد دارو هستند. اين محققان کپسولهاي جديدي در مقياس نانو و ميکرو طراحي کردهاند که حاوي راهنماييهاي کدشده ژنتيکي و خطوط توليد براي سنتز پروتئينها هستند؛ اين خطوط توليد را ميتوان با استفاده از يک سيگنال خارجي فعال کرد.
دانشمندان نوعي کپسول کوچک براي درمان بيماريها توليد کردهاند که حاوي دارو نيست، بلکه حاوي DNA و ماشينآلات زيستي ديگر براي توليد دارو هستند. اين محققان کپسولهاي جديدي در مقياس نانو و ميکرو طراحي کردهاند که حاوي راهنماييهاي کدشده ژنتيکي و خطوط توليد براي سنتز پروتئينها هستند؛ اين خطوط توليد را ميتوان با استفاده از يک سيگنال خارجي فعال کرد. محققان انگليسي با پيوند سلولهاي گيرنده نور به شبكيه چشم موشهاي كور، موفق به درمان نابينايي آنها شدند. محققان موسسه چشم پزشكي كالج لندن در اين تحقيق سلولهاي گيرنده نور (فتورسپتور) را از موشهاي سالم استخراج كرده و به شبكيه موشهاي شب كور پيوند زدند. دو نوع گيرنده نوري ميلهاي و مخروطي در چشم وجود دارد كه سلول هاي پيوندي از نوع سلولهاي نابالغ ميلهاي شكلاند كه مسؤول قدرت بينايي در نور كم بويژه ديد شب هستند. در تحقيقات قبلي مشخص شده بود كه پيوند سلولهاي مخروطي به چشم بسيار دشوار است. پس از گذشت چهار تا شش هفته، از هر شش سلول پيوندي يك سلول قادر به برقراري ارتباط براي انتقال اطلاعات بصري به مغز بود.
محققان انگليسي با پيوند سلولهاي گيرنده نور به شبكيه چشم موشهاي كور، موفق به درمان نابينايي آنها شدند. محققان موسسه چشم پزشكي كالج لندن در اين تحقيق سلولهاي گيرنده نور (فتورسپتور) را از موشهاي سالم استخراج كرده و به شبكيه موشهاي شب كور پيوند زدند. دو نوع گيرنده نوري ميلهاي و مخروطي در چشم وجود دارد كه سلول هاي پيوندي از نوع سلولهاي نابالغ ميلهاي شكلاند كه مسؤول قدرت بينايي در نور كم بويژه ديد شب هستند. در تحقيقات قبلي مشخص شده بود كه پيوند سلولهاي مخروطي به چشم بسيار دشوار است. پس از گذشت چهار تا شش هفته، از هر شش سلول پيوندي يك سلول قادر به برقراري ارتباط براي انتقال اطلاعات بصري به مغز بود.  دانشمندان دانشگاه 'یو سی ال ای' روشی را یافتند كه بر اساس آن به واسطه دستكاری ژنتیكی سلولهای بنیادین انسان میتوان سلولهای جدیدی را برای مبارزه با ویروس اچ آی وی تولید كرد. دانشمندان سلولهای جدید را به بدن موشهای آلوده به ویروس 'اچ آی وی وارد و این سلولها مستقیماً به بافتهای آلوده به ویروس حمله كردند. این اولین باری است كه دانشمندان با دستكاری ژنتیكی موفق به ساخت نوعی سلول ایمنی شدهاند كه ویروس اچ آی وی را درون یك بافت زنده مورد حمله قرار میدهد.
دانشمندان دانشگاه 'یو سی ال ای' روشی را یافتند كه بر اساس آن به واسطه دستكاری ژنتیكی سلولهای بنیادین انسان میتوان سلولهای جدیدی را برای مبارزه با ویروس اچ آی وی تولید كرد. دانشمندان سلولهای جدید را به بدن موشهای آلوده به ویروس 'اچ آی وی وارد و این سلولها مستقیماً به بافتهای آلوده به ویروس حمله كردند. این اولین باری است كه دانشمندان با دستكاری ژنتیكی موفق به ساخت نوعی سلول ایمنی شدهاند كه ویروس اچ آی وی را درون یك بافت زنده مورد حمله قرار میدهد.  محققان انگليسي با استفاده از سلولهاي بنيادي كره چشم انسان موفق شدند بخشي از بينايي را به موشهاي نابينا بازگردانند. گلوكوم يا آب سياه در اثر افزايش فشار داخل چشمي ايجاد ميشود و در اين حالت سلولهاي گانگليوني شبكيه كه مسؤول انتقال اطلاعات از شبكيه به مغز هستند، از بين ميروند و فرد به مرور زمان بينايي خود را از دست ميدهد. محققان دانشگاه لندن و بيمارستان چشم پزشكي مورفيلد اعلام كردهاند كه موفق به بازسازي سلولهاي گانگليوني شبكيه چشم موش با استفاده از سلولهاي بنيادي چشم انسان شدهاند. در اين شيوه درماني از سلولهاي بنيادي استخراج شده از اعصاب جديد در پشت كره چشم استفاده شده است.
محققان انگليسي با استفاده از سلولهاي بنيادي كره چشم انسان موفق شدند بخشي از بينايي را به موشهاي نابينا بازگردانند. گلوكوم يا آب سياه در اثر افزايش فشار داخل چشمي ايجاد ميشود و در اين حالت سلولهاي گانگليوني شبكيه كه مسؤول انتقال اطلاعات از شبكيه به مغز هستند، از بين ميروند و فرد به مرور زمان بينايي خود را از دست ميدهد. محققان دانشگاه لندن و بيمارستان چشم پزشكي مورفيلد اعلام كردهاند كه موفق به بازسازي سلولهاي گانگليوني شبكيه چشم موش با استفاده از سلولهاي بنيادي چشم انسان شدهاند. در اين شيوه درماني از سلولهاي بنيادي استخراج شده از اعصاب جديد در پشت كره چشم استفاده شده است.  دانشمندان موسسه فناوري ماساچوست اخيرا موفق به ساخت يك دستگاه انتقال آراناي شدهاند كه در آن اين ماده در كرههاي ريز با تراكم بالا بستهبندي شده تا به سلامت به مقصد مورد نظر برسد. در دهه گذشته دانشمندان به دنبال درمانهاي مبتني بر دخالت آراناي بودهاند كه ژنهاي ناقص را مسدود ميكند؛ اما تنها مشكل آنها شناسايي شيوهاي براي انتقال آن به مقصد بود.در اكثر موارد آراناي مداخلهگر كوتاه در مواجهه با آنزيمهايي كه عليه عفونت ويروسهاي آراناي مبارزه ميكنند، به سرعت درون بدن تجزيه ميشوند.اين محققان با سيستم جديد خود كه در مجله Nature Material منتشر شده، توانستند بيان ژنهاي خاص را با دوز كمتري از ذرات مسدود كنند.چنين ذراتي ميتوانند به ارائه يك شيوه جديد براي درمان سرطان و همچنين ديگر بيماريهاي مزمن كه در پي ژنهاي ناقص ايجاد شدهاند، بپردازند.
دانشمندان موسسه فناوري ماساچوست اخيرا موفق به ساخت يك دستگاه انتقال آراناي شدهاند كه در آن اين ماده در كرههاي ريز با تراكم بالا بستهبندي شده تا به سلامت به مقصد مورد نظر برسد. در دهه گذشته دانشمندان به دنبال درمانهاي مبتني بر دخالت آراناي بودهاند كه ژنهاي ناقص را مسدود ميكند؛ اما تنها مشكل آنها شناسايي شيوهاي براي انتقال آن به مقصد بود.در اكثر موارد آراناي مداخلهگر كوتاه در مواجهه با آنزيمهايي كه عليه عفونت ويروسهاي آراناي مبارزه ميكنند، به سرعت درون بدن تجزيه ميشوند.اين محققان با سيستم جديد خود كه در مجله Nature Material منتشر شده، توانستند بيان ژنهاي خاص را با دوز كمتري از ذرات مسدود كنند.چنين ذراتي ميتوانند به ارائه يك شيوه جديد براي درمان سرطان و همچنين ديگر بيماريهاي مزمن كه در پي ژنهاي ناقص ايجاد شدهاند، بپردازند.