همایش628- اولین کنگره بین المللی و ششمین همایش یادگیری الکترونیکی در علوم پزشکی
برگزار کننده: دانشگاه علوم پزشکی شیراز
زمان برگزاری: ۱ الی ۳ آبان ۱۳۹۲
ارسال خلاصه مقالات: ۳۰/۳/۱۳۹۲
مکان برگزاری: شیراز
برگزار کننده: دانشگاه علوم پزشکی شیراز
زمان برگزاری: ۱ الی ۳ آبان ۱۳۹۲
ارسال خلاصه مقالات: ۳۰/۳/۱۳۹۲
مکان برگزاری: شیراز
برگزار کننده: بنیاد بیماری های نادر
زمان برگزاری: ۹ الی ۹ اسفند ۱۳۹۱
مکان برگزاری: تهران، مرکز همایش های بین المللی صدا و سیما
برگزارکننده: کانون هم اندیشی سرطان کولورکتال مجتمع بیمارستانی امام خمینی تهران
زمان برگزاری: ۴ الی ۵ اردیبهشت ۱۳۹۲
مکان برگزاری: تهران، بیمارستان امام
نوشیدن چای سبز با جلوگیری از وقوع بیماریهای لثه لبخند زیباتری را برای شما به ارمغان میآورد. نتایج یک مطالعه در ژاپن نشان داد افرادی که چای سبز بیشتری مینوشند لثه سالمتری دارند و با مصرف آن خطر ابتلا به بیماریهای پریودنتال، فرونشینی لثه و خونریزی لثه را در خود کاهش میدهند که این میتواند در داشتن لبخندی زیبا بسیار مؤثر باشد. این تحقیق میافزاید: خطر وقوع بیماریهای لثه که به وسیله واکنشهای التهابی به باکتریهای موجود در دهان ایجاد میشود، میتواند تنها با نوشیدن یک فنجان چای سبز در روز کاهش یابد. محققان افزودند: قدرت سلامتی چای سبز به دلیل خواص آنتیاکسیدانی فیتوکمیکالهای فلاونوئیدی به نام کاتچین است که با التهاب ناشی از بیماری پریودنتال مبارزه میکند و برخلاف چای سیاه حاوی بیشترین میزان کاتچین است.
نتایج دیگر این مطالعه نشان داد چای سبز ضمن اینکه عوارض جانبی جدی ندارد میتواند از سرطان پیشگیری کند و به از دست دادن وزن کمک کند اما ممکن است اثرات تحریک کنندهای بر سیستم عصب مرکزی داشته باشد و به همین دلیل کسانی که از اختلال خواب رنج میبرند نباید از چای سبز زیاد استفاده کنند و نیز زنان باردار و شیرده باید از نوشیدن آن اجتناب کنند. به گفته محققان افراد میتوانند به جای نوشیدن یک بطری نوشابه که فروپاشی استخوانها و دندانها را در پی دارد، یک فنجان چای سبز بنوشند و لذت داشتن یک لبخند زیبا را تجربه کنند. یافتههای این تحقیق در نشریه آنلاین MC منتشر شده است.
 پژوهش جدید دانشمندان دانشگاه وولورهامپتون نشان داد که طب سنتی آفریقایی ممکن است از کلید درمان زخمهایی برخوردار باشد که با طب مدرن در تضاد است. طبق این درمان، ریختن شکر ریز بر روی زخمهای بد مانند زخم پا یا حتی قطع عضو میتواند فرآیند درمان را در زمان شکست آنتیبیوتیکها و درمانهای دیگر ارتقا بخشد. این پژوهش توسط موسی موراندو، مدرس ارشد دانشکده پرستاری بزرگسالان در دانشگاه وولورهامپتون انجام شده که در زیمباوه رشد کرده و پدرش در زمان بچگی از شکر برای ترمیم زخمها و کاهش درد استفاده میکرده است. شکر آب را از زخم به یک پارچه انتقال داده که محیط مورد نیاز باکتری برای رشد را از بین میبرد و فرآیند بهبود زخم را تسریع میکند. تاکنون 35 بیمار که از این درمان بهرهمند شدهاند، با بهبود شرایط خود مواجه شده و هیچگونه عوارض جانبی نیز گزارش نشده است. این درمان از این رو موفق بوده که باکتری برای رشد به آب نیاز دارد از این رو قرار دادن شکر بر روی زخم باعث کشیدن آب شده و محیط مناسب رشد باکتری را از بین میبرد.
پژوهش جدید دانشمندان دانشگاه وولورهامپتون نشان داد که طب سنتی آفریقایی ممکن است از کلید درمان زخمهایی برخوردار باشد که با طب مدرن در تضاد است. طبق این درمان، ریختن شکر ریز بر روی زخمهای بد مانند زخم پا یا حتی قطع عضو میتواند فرآیند درمان را در زمان شکست آنتیبیوتیکها و درمانهای دیگر ارتقا بخشد. این پژوهش توسط موسی موراندو، مدرس ارشد دانشکده پرستاری بزرگسالان در دانشگاه وولورهامپتون انجام شده که در زیمباوه رشد کرده و پدرش در زمان بچگی از شکر برای ترمیم زخمها و کاهش درد استفاده میکرده است. شکر آب را از زخم به یک پارچه انتقال داده که محیط مورد نیاز باکتری برای رشد را از بین میبرد و فرآیند بهبود زخم را تسریع میکند. تاکنون 35 بیمار که از این درمان بهرهمند شدهاند، با بهبود شرایط خود مواجه شده و هیچگونه عوارض جانبی نیز گزارش نشده است. این درمان از این رو موفق بوده که باکتری برای رشد به آب نیاز دارد از این رو قرار دادن شکر بر روی زخم باعث کشیدن آب شده و محیط مناسب رشد باکتری را از بین میبرد.
محققان دانشگاه دوک موفق به ارائه روشی شدهاند که میتواند سطح کلر را در سلولهای عصبی کنترل کند. این ماده مسئول دردهای مزمن و بیماری صرع است. این گروه تحقیقاتی موفق شده است که سطح کلر را در سلولهای عصبی و مغز موشها کنترل کند. از این یافته میتوان در درمان بیماریهای عصبی استفاده کرد. نتایج این پژوهش در نشریه Small به چاپ رسیده است.
نانولولههای کربنی موادی هستند که دارای خواص فیزیکی، مکانیکی و الکتریکی منحصر بهفرد میباشند. این ویژگیها در کنار ابعاد کوچک نانولولهها موجب شده تا بتوان از آنها در حوزه پزشکی استفاده کرد. در دنیایی که رایانهها و تلفنهای همراه کوچکتر میشوند، نانولولههای کربنی میتواند راه حل مناسبی برای بهبود تراشهها باشد. برای کسانی که از مشکل جراحات مغزی رنج میبرند، استفاده از ادوات مبتنی بر نانولوله کربنی میتواند گزینه مناسبی باشد. ولفگانگ لیدتک، استادیار بخش عصب شناسی و پزشکی دانشگاه دوک میگوید: نانولولههای کربنی دارای کاربردهای وسیعی میباشند. علاوهبر خواص مکانیکی، نانولولهها دارای خواص الکترونیکی منحصر بهفردی هستند که میتوان از این ویژگی برای تولید دستگاههایی که با سیستم عصبی در تماس هستند استفاده کرد. با این حال مکانسیم دقیق عملکرد نانولوله کربنی و تاثیر آن بر اعصاب هنوز برای ما ناشناخته است. جرج بارت گلر میگوید همه نانولولههای کربنی یکسان نیستند. او موفق به تولید نانولولههای ویژهای شده که بسیار خالص هستند. این نانولولهها که دارای چند جداره هستند از ویژگیهای منحصر بهفردی بهرهمند هستند.
در قدم اول پژوهشگران بهدنبال این سوال بودند که آیا نانولولههای کربنی روی سیستم عصبی تاثیر منفی دارد؟ نتایج نشان داد که این نانولولهها موجب تقویت و بزرگتر شدن سیستم عصبی میشود. لیو میگوید پیش از این تحقیقات مشابهی انجام شده بود اما به دلیل وجود ناخالصیهایی در نانولوله، نتایج کاملا متفاوت بود اما در این پژوهش از نانولولههای کربنی چندجداره استفاده شد که موجب تسریع رشد سلولهای عصبی شد. رشتههای عصبی در اثر افزایش غلظت کلر میتوانند دچار آسیب شوند. برخی بیماریها نظیر صرع و دردهای مزمن نتیجه این آسیبدیدگیهاست.
نوعی پروتئین موسوم به KCC2 میتواند کلر را از سلول خارج کند. محققان دریافتند که در اثر افزودن نانولوله کربنی به سیستم عصبی پروتئین بیشتری تولید شده و در نهایت سطح کلر کاهش مییابد. افزایش این پروتئین موجب افزایش کلسیم در نرونهای عصبی نیز میشود، کلسیم نیز میتواند نوعی پروتئین بهنام CaMKII را در مغز ایجاد کرده که این پروتئین نیز موجب تولید بیشتر KCC2 میشود.
برگزار کنندگان: دانشگاه علوم پزشکی تبریز، انجمن علوم اعصاب ایران، انجمن استروک ایران
زمان برگزاری: ۶ الی ۸ آذر ۱۳۹۲
ارسال خلاصه مقالات: ۳۱ مرداد ۱۳۹۲
مکان برگزاری: تبریز
 دانشمندان درحال بررسی درمان درد مفاصل با تزریق خون به زانوی بیمار هستند. در این درمان سعی بر این است که سطوح یک ترکیب طبیعی موسوم به گیرنده آنتاگونیست اینترلوکین1 افزایش یابد. تصور میشود که این ترکیب نقش مهمی در کاهش التهاب داشته باشد. دانشمندان بر این باورند که مقدار کاهش یافته این آنتاگونیست با فروپاشی غضروف در مفاصل مرتبط است. در این درمان جدید، خون از دست بیمار گرفته شده و در یک انکوباتور که با دانههای شیشهای ویژه طراحی شده است، قرار داده میشود. این دانهها به تولید واکنشی که سطوح ترکیب اینترلوکین1 را در یک دوره 9 ساعته افزایش داده، کمک میکند. این خون سپس از دستگاه خارج شده و دوباره طی شش تزریق به بیمار برگردانده میشود. پژوهشهای ابتدایی بر روی گروه کوچکی از بیماران نشان داد که این تزریقها میتوانند پس از یک دوره سه ماهه درد را تسکین داده و حرکت فرد را ارتقا بخشند.
دانشمندان درحال بررسی درمان درد مفاصل با تزریق خون به زانوی بیمار هستند. در این درمان سعی بر این است که سطوح یک ترکیب طبیعی موسوم به گیرنده آنتاگونیست اینترلوکین1 افزایش یابد. تصور میشود که این ترکیب نقش مهمی در کاهش التهاب داشته باشد. دانشمندان بر این باورند که مقدار کاهش یافته این آنتاگونیست با فروپاشی غضروف در مفاصل مرتبط است. در این درمان جدید، خون از دست بیمار گرفته شده و در یک انکوباتور که با دانههای شیشهای ویژه طراحی شده است، قرار داده میشود. این دانهها به تولید واکنشی که سطوح ترکیب اینترلوکین1 را در یک دوره 9 ساعته افزایش داده، کمک میکند. این خون سپس از دستگاه خارج شده و دوباره طی شش تزریق به بیمار برگردانده میشود. پژوهشهای ابتدایی بر روی گروه کوچکی از بیماران نشان داد که این تزریقها میتوانند پس از یک دوره سه ماهه درد را تسکین داده و حرکت فرد را ارتقا بخشند.
 پژوهشگران دانشگاه اوتاوا مکانیزمی را کشف کردهاند که طی آن سلولهای بنیادی عضله به چربی قهوهای تبدیل میشود؛ این نوع چربی نقش جدی را در مبارزه با چاقی ایفا میکند. براساس گزارش سازمان سلامت جهانی، چاقی به عنوان پنجمین عامل مرگ در سراسر جهان به شمار میرود که به طور آماری سالانه حدود 2.8 میلیون نفر در جهان به علت تاثیرات اضافه وزن بر وضعیت سلامتیشان، جان خود را از دست میدهند. دکتر "مایکل رودنیکی"، سرپرست این پژوهش و رییس مرکز تحقیقات ژنتیک مولکولی کانادا طی این مطالعه برای نخستین بار نشان داده است که سلولهای بنیادی عضله نه تنها توانایی تولید فیبرهای عضلانی را دارند بلکه قابلیت تبدیل به چربی قهوهای را نیز دارند.
پژوهشگران دانشگاه اوتاوا مکانیزمی را کشف کردهاند که طی آن سلولهای بنیادی عضله به چربی قهوهای تبدیل میشود؛ این نوع چربی نقش جدی را در مبارزه با چاقی ایفا میکند. براساس گزارش سازمان سلامت جهانی، چاقی به عنوان پنجمین عامل مرگ در سراسر جهان به شمار میرود که به طور آماری سالانه حدود 2.8 میلیون نفر در جهان به علت تاثیرات اضافه وزن بر وضعیت سلامتیشان، جان خود را از دست میدهند. دکتر "مایکل رودنیکی"، سرپرست این پژوهش و رییس مرکز تحقیقات ژنتیک مولکولی کانادا طی این مطالعه برای نخستین بار نشان داده است که سلولهای بنیادی عضله نه تنها توانایی تولید فیبرهای عضلانی را دارند بلکه قابلیت تبدیل به چربی قهوهای را نیز دارند.
چربی قهوهای، بافت چربی سوزی است که در گرم نگه داشتن و تنظیم دمای بدن نقش مهمی را ایفا میکند. علاوه بر این وجود هرچه بیشتر چربی قهوهای با کاهش هرچه بیشتر چاقی مرتبط است. نکته اصلی در روند تبدیل سلول بنیادی عضله به چربی قهوهای، تنظیم کننده ژنی به نام "microRNA-133" است که به هنگام حضورش، سلولهای بنیادی به فیبرهای عضلانی تبدیل میشوند و زمانی که کاهش مییابد، سلولهای عضلانی به چربی قهوهای تبدیل میشوند.
دانشمندان طی این پژوهش نشان دادند زمانی که به موشهای بالغ عامل کاهش دهنده "microRNA-133" موسوم به "الیگو نوکلئوتید آنتی سنس ASO" تزریق میشود، چربی قهوهای بیشتری را تولید میکنند که موجب حفاظت بدن از چاقی و بهبود توانایی بدن در پردازش قند خون میشود. علاوه بر این، پس از چهار ماه نیز مشاهده شد که تزریق "ASO" به عضله پای عقبی موش باعث افزایش تولید انرژی کل بدن میشود. محققان خاطرنشان کردهاند که گرچه نتایج به دست آمده جالب و چشمگیر است، اما هنوز در مراحل ابتدایی به سر میبرد و تحقیقات زیادی برای تایید قطعی و سووالات زیادی که در پی این نتایج مطرح میشود، لازم است. این تحقیق در مجله معتبر "Cell Metabolism" منتشر شده است.
 محققان موسسه فرانهوفر آلمان، دسته سنجش فشار ابزار جراحی مجهز به لامپ LED طراحی کرده اند که میزان فشار وارده در حین عمل جراحی را مشخص می کند. عصر جراحی رباتیک هر روز شاهد یک ابتکار خلاقانه است و دسته هوشمند جراحی نیز میتواند به عنوان یک ابزار بصری به پزشکان جوان و کم تجربه در حین اعمال جراحی کمک کند.
محققان موسسه فرانهوفر آلمان، دسته سنجش فشار ابزار جراحی مجهز به لامپ LED طراحی کرده اند که میزان فشار وارده در حین عمل جراحی را مشخص می کند. عصر جراحی رباتیک هر روز شاهد یک ابتکار خلاقانه است و دسته هوشمند جراحی نیز میتواند به عنوان یک ابزار بصری به پزشکان جوان و کم تجربه در حین اعمال جراحی کمک کند.
دسته سنجش فشار توسط محققان موسسه فرانهوفر با همکاری موسسه وبر طراحی شده و میزان فشار وارده بر روی ابزار مختلف جراحی را با روشن شدن یک لامپ LED مشخص می کند. طول این دسته هوشمند تنها 9 سانتی متر است که بر روی تمامی ابزارهای جراحی استاندارد از جمله «اسپریدر» قابل استفاده است و علاوه بر محافظت از قطعات الکترونیک، فاقد هرگونه شکاف یا درز برای ورود و تجمع باکتری می باشد. حسگرهای تعبیه شده درون دسته، میزان نیروی وارده به ابزار جراحی را محاسبه می کنند و با رسیدن به محدوده از پیش تعیین شده، لامپ LED قرمز رنگ دستگاه روشن می شود که هشدار لازم را برای اعمال فشار بیشتر یا کمتر به جراح می دهد. شارژ دسته سنجش فشار بصورت بی سیم انجام می شود و یک پوشش سیلیکون شفاف، امکان مشاهده نور قرمز رنگ و استرلیزه شدن تا دمای 134 درجه سانتیگراد را بدون آسیب به قطعات الکترونیکی فراهم می کند. نمونه اولیه دستگاه ابداعی محققان موسسه فرانهوفر در نمایشگاه Medtec از 26 تا 28 فوریه 2013 میلادی (هشتم تا دهم اسفند) در شهر اشتوتگارت آلمان معرفی می شود.
 پژوهشگران موسسه فناوری سلطنتی ملبورن، نانوذراتی تولید کردهاند که بسیار ارزان و غیرسمی بوده و از آن میتوان برای رادیودرمانی سرطان استفاده کرد. این نانوذرات میتواند جایگزین نانوذرات گرانقیمت طلا در درمان سرطان شود. این تیم تحقیقاتی استرالیایی روی یافتن جایگزینی برای نانوذرات طلا کار میکنند تا از آن در درمان سرطان استفاده کنند. نانوذرات طلا بسیار گرانقیمت و تا حدی سمی است. محمود القطامی میگوید: ما دریافتیم که بیسموت میتواند گزینه ایدهآلی باشد. تستهای ما نشان داد اگر از نانوذرات بیسموت استفاده شود، مقدار تابش دو برابر شده و سلولهای سرطانی از بین میروند. در واقع اگر مقدار تابش را بتوان افزایش داد، آن گاه میتوان مقدار دوز ماده رادیودرمانی را کاهش داد؛ با این کار بیمار کمتر در معرض اثرات منفی این داروها قرار میگیرد. وی میافزاید: نانوذرات فلزی میتوانند موجب بهبود و افزایش کارایی رادیودرمانی شوند، اما باید از موادی ارزانتر و ایمنتر برای این کار استفاده کرد.
پژوهشگران موسسه فناوری سلطنتی ملبورن، نانوذراتی تولید کردهاند که بسیار ارزان و غیرسمی بوده و از آن میتوان برای رادیودرمانی سرطان استفاده کرد. این نانوذرات میتواند جایگزین نانوذرات گرانقیمت طلا در درمان سرطان شود. این تیم تحقیقاتی استرالیایی روی یافتن جایگزینی برای نانوذرات طلا کار میکنند تا از آن در درمان سرطان استفاده کنند. نانوذرات طلا بسیار گرانقیمت و تا حدی سمی است. محمود القطامی میگوید: ما دریافتیم که بیسموت میتواند گزینه ایدهآلی باشد. تستهای ما نشان داد اگر از نانوذرات بیسموت استفاده شود، مقدار تابش دو برابر شده و سلولهای سرطانی از بین میروند. در واقع اگر مقدار تابش را بتوان افزایش داد، آن گاه میتوان مقدار دوز ماده رادیودرمانی را کاهش داد؛ با این کار بیمار کمتر در معرض اثرات منفی این داروها قرار میگیرد. وی میافزاید: نانوذرات فلزی میتوانند موجب بهبود و افزایش کارایی رادیودرمانی شوند، اما باید از موادی ارزانتر و ایمنتر برای این کار استفاده کرد.
نانوذرات بیسموت گزینه مناسبی برای این کار است، زیرا قیمت هر گرم آن تنها چند دلار است، در حالی که هر گرم نانوذرات طلا هزاران دلار قیمت دارد. از سوی دیگر نانوذرات بیسموت غیرسمی بوده و عوارض جانبی اندکی دارد. القطامی میگوید: با این حال هنوز باید تحقیقات بیشتری در این باره انجام داد تا بتوان از این سیستم در درمان سرطان استفاده کرد. نتایج این پژوهش بسیار جالب توجه بوده و انگیزههای ما را برای ادامه تحقیقات افزایش میدهد.
القطامی با چند گروه تحقیقاتی از دانشگاه ملبورن، موسسه تحقیقاتی سلامت در موسسه فناوری سلطنتی ملبورن، دانشگاه سری و موسسه تحقیقات سرطان برای انجام این پروژه همکاری داشته است. برای تست کارایی بیسموت، القطامی نانوذرات بیسموت را درون یک شناساگر قرار داد؛ شناساگری که توسط همین گروه تحقیقاتی ساخته شده بود. آنها با استفاده از این شناساگر مقدار دوز تابش را در سه بعد اندازهگیری کردند.
محققان نمونه و شناساگر را در معرض تابش نرمال مورد استفاده در درمان سرطان قرار دادند. مقدار تابش مورد نیاز برای رهاسازی در نانوذرات بیسموت با دوز مورد نیاز برای درمان با نانوذرات طلا مقایسه شد. نتایج نشان داد که نانوذرات مبتنی بر بیسموت تابش را 90 درصد افزایش میدهند. این تیم تحقیقاتی قصد دارد که مطالعات بیشتری انجام دهد تا یافتههای خود را اعتبار بیشتری ببخشد. با این کار مسیر استفاده از این روش برای درمان سرطان هموار میشود. نتایج این پژوهش در کنفرانس بین المللی دوزیمتری تابش سه بعدی در سیدنی ارائه شده است.
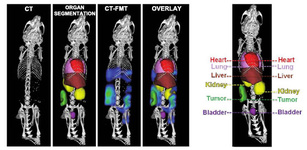 یک تیم تحقیقات بینالمللی روشی جدید برای رصد زیست مولکولها در بدن ارائه کرده است. این روش ترکیبی از سی تی اسکن و تصویربرداری انعکاسی فلورسانس است. یکی از کلیدیترین مسائل در توسعه روشهای جدید در نانوپزشکی آن است که بتوان حرکت حملکنندههای دارو را در بدن رصد کرد، با این کار میتوان فهمید که دارو به کجا میرود و چگونه اثر میکند. برای تولید محصولی که بتواند تاییدیههای لازم را بگیرد و برای درمان بیماران مورد استفاده قرار گیرد، باید روشی غیرمخرب برای تست نانوداروها ارائه کرد. وان لامرز از دپارتمان تصویربرداری مولکولی موسسه هلمهولتز و دانشگاه آخن آلمان میگوید: تمام مطالعاتی که پیش از این در این حوزه انجام شده، مبتنی بر تصویربرداری انعکاسی فلورسانس (FRI) دو بعدی است. یکی از مشکلات استفاده از این سیستم دو بعدی آن است که نمیتوان ترکیبات فلورسانس را در بافتهای عمیق شناسایی کرد، بنابراین سیستم توموگرافی مولکولی فلورسانس سه بعدی پیشنهاد شد. فقدان اطلاعات آناتومی، سد راه استفاده از این سیستم سه بعدی بوده است.
یک تیم تحقیقات بینالمللی روشی جدید برای رصد زیست مولکولها در بدن ارائه کرده است. این روش ترکیبی از سی تی اسکن و تصویربرداری انعکاسی فلورسانس است. یکی از کلیدیترین مسائل در توسعه روشهای جدید در نانوپزشکی آن است که بتوان حرکت حملکنندههای دارو را در بدن رصد کرد، با این کار میتوان فهمید که دارو به کجا میرود و چگونه اثر میکند. برای تولید محصولی که بتواند تاییدیههای لازم را بگیرد و برای درمان بیماران مورد استفاده قرار گیرد، باید روشی غیرمخرب برای تست نانوداروها ارائه کرد. وان لامرز از دپارتمان تصویربرداری مولکولی موسسه هلمهولتز و دانشگاه آخن آلمان میگوید: تمام مطالعاتی که پیش از این در این حوزه انجام شده، مبتنی بر تصویربرداری انعکاسی فلورسانس (FRI) دو بعدی است. یکی از مشکلات استفاده از این سیستم دو بعدی آن است که نمیتوان ترکیبات فلورسانس را در بافتهای عمیق شناسایی کرد، بنابراین سیستم توموگرافی مولکولی فلورسانس سه بعدی پیشنهاد شد. فقدان اطلاعات آناتومی، سد راه استفاده از این سیستم سه بعدی بوده است.
«لامرز» میگوید: این سیستم با پیمایشگرهای قابل فعال شدن مولکولی که برای تشخیص طبی استفاده میشود، بسیار متفاوت است. اخیرا «نتزیا چریسستوز» و همکارانش مقالهای تحت عنوان «FMT-XCT: in vivo animal studies with hybrid fluorescence molecular tomography–X-ray computed tomography» را به چاپ رساندند که در آنها از ترکیب CT-FMT استفاده شده است. این ترکیب میتواند ابزار خوبی برای تحقیق در محیط زنده باشد. این سیستم را «لامرز» و همکارانش اخیرا ارائه کردهاند.
در این پروژه محققانی از دانشگاه اوتریخت، دانشگاه تونتی و آکادمی علوم جمهوری چک شرکت داشتند. این گروه نتایج کار خود را در قالب مقالهای تحت عنوان «Noninvasive Optical Imaging of Nanomedicine Biodistribution» در نشریه ACS Nano به چاپ رساندند. این گروه تحقیقاتی موفق شده است تا مواد زیستی را به تصویر کشیده و تجمع آنها را در محل مورد نظر نشان دهد، این کار با استفاده از سیستم تصویربرداری ترکیبی 3D CT-FMT انجام شده است. این تیم تحقیقاتی با استفاده از توموگرافی کامپیوتری موفق به آنالیز دقیق محل پیمایشگر درون بافت شده است، چیزی که با استفاده از 2D FRI و 3D FMT غیرممکن است. «لامرز» میگوید: روشهای تصویربرداری نوری برای نشان دادن رفتار داروها درون بدن بسیار پرمشقت است، اما با این روشی که ما ارائه کردیم، میتوان مقدار تجمع را درون بدن بیمار در بخشهای بسیار عمیق نشان داد. محققان میگویند که هنوز باید تحقیقات بیشتری انجام شود تا بتوان از این سیستم استفاده کرد. محققان در حال حاضر در تلاش برای بهینه کردن این روش هستند.
 محققان دانشگاه رایس روشی ارائه کردهاند که با استفاده از آن میتوان برخی سلولهای بیمار را از بین برد و برخی دیگر را درمان کرد. این فرآیند با استفاده از پرتو لیزر پالسی فعال شده و میتوان با استفاده از آن برخی سلولها را تحت تاثیر قرار داد، در حالی که سلولهای مجاور سلول مورد نظر بدون تغییر باقی بمانند. در این روش از نانوحبابهای پلاسمونیک قابل تنظیم استفاده شده است که میتواند جایگزینی مناسبی برای روشهای چند مرحلهای فعلی برای درمان سرطان باشد. همچنین این روش جدید بسیار سریعتر است.
محققان دانشگاه رایس روشی ارائه کردهاند که با استفاده از آن میتوان برخی سلولهای بیمار را از بین برد و برخی دیگر را درمان کرد. این فرآیند با استفاده از پرتو لیزر پالسی فعال شده و میتوان با استفاده از آن برخی سلولها را تحت تاثیر قرار داد، در حالی که سلولهای مجاور سلول مورد نظر بدون تغییر باقی بمانند. در این روش از نانوحبابهای پلاسمونیک قابل تنظیم استفاده شده است که میتواند جایگزینی مناسبی برای روشهای چند مرحلهای فعلی برای درمان سرطان باشد. همچنین این روش جدید بسیار سریعتر است.
نانوحبابهای پلاسمونیک دههزار برابر کوچکتر از قطر تار موی انسان هستند که میتوانند بترکند. زمانی که نانوذرات طلا در معرض تابش لیزر با قدرت بالا قرار گیرند، حبابهایی در اطراف آنها ایجاد میشود. این حبابها که در اثر تبخیر یک لایه محلول اطراف نانوذرات ایجاد میشوند، عمر کوتاهی داشته و به سرعت میترکند. «لاپوتکو» و همکارانش دریافتند که این نانوحبابهای پلاسمونیک قادرند سلولهای سرطانی را از بین ببرند، بدون این که به سلولهای سالم آسیبی وارد شود. «لاپوتکو» میگوید: این روش بسیار دقیق است و از نظر دقت و انتخابگری بسیار بهتر از زمانی است که تنها از نانوذرات طلا استفاده میشود.
این پژوهش قدمهای رو به جلوی قابل توجهی برای درمان سرطان برداشته است. یکسِری آزمایشات درباره عملکرد این روش انجام شده است که در آن از لیزرهای پالسی برای ایجاد نانوحباب پلاسمونیک استفاده شده است، نانوحبابهایی که در اطراف نانوذرات توخالی تشکیل میشود. نتایج این آزمایشها نشان میدهد که این نانوحبابها قادرند سلولهای ناخواسته را به صورت انتخابی از بین ببرند. همچنین این لیزر میتواند در اطراف نانوکرههای طلا نانوحبابهایی ایجاد کند، این نانوحبابها موجب فشار روی دیواره سلول شده و با استفاده از آن دارو یا ژن به درون سلول تزریق میشود.
در یک آزمایش، محققان از نانوذرات توخالی 60 نانومتری استفاده کرده و سلولهای سرطانی را به رنگ قرمز در آوردند، در آزمایش دیگری آنها همان نوع سلولها را به رنگ آبی در آوردند. سپس این سلولها را با هم ترکیب کرده و در معرض تابش لیزر قرار داده تا رنگ سبز از بین برود. مشاهدات میکروسکوپی نشان داد که سلولهای قرمز در اثر نانوحبابهای پلاسمونیک بزرگ از بین رفتهاند، اما سلولهای آبی که در معرض نانوحبابهای کوچک بودند، دستنخورده باقی مانده و مقداری مایع سبز درون آنها وارد شده بود.
يافتههاي حاصل از شرح حال در تشخيص اختلالات دروني زانو تا حدي ارزش دارند اما در اغلب موارد انجام معاينه فيزيکي دقيق ميتواند وجود شکستگي و آسيب ليگامانها و منيسکها را رد نمايد. قاعده زانوي اتاوا (Ottawa Knee Rule) ميتواند در تعيين بيماران نيازمند راديوگرافي به پزشکان کمک کند. مثبت بودن آزمونهاي معاينه فيزيکي و وجود يافتههايي مبني بر افيوژن حاد مطرحکننده وجود اختلالات دروني مفصل زانو است. غير طبيعي بودن آزمون مکموري يا تسالي قويا نشانگر آسيب منيسک خواهد بود در حالي که طبيعي بودن آزمون تسالي، ميتواند آسيب منيسک را رد کند. نبود شواهد افيوژن مفصلي احتمال اختلالات دروني مفصل را به صورت قابل ملاحظهاي کاهش ميدهد. انجام MRI براي رد اختلالات دروني زانو بايد براي بيماراني درخواست شود که داراي يافتههاي مقتضي در شرح حال و معاينه فيزيکي هستند
آرتريت روماتوييد شايعترين بيماري التهابي سيستميک مفاصل است که تاکنون شناخته شده است. زنان، سيگاريها و افراد داراي سابقه خانوادگي مثبت بيشتر به اين بيماري مبتلا ميشوند. معيارهاي تشخيصي شامل درگيري حداقل يک مفصل همراه با تورم مشخصه آن است که با بيماري ديگري قابل توجيه نباشد. احتمال تشخيص آرتريت روماتوييد با افزايش تعداد مفاصل کوچک درگير افزايش مييابد. در افراد مبتلا به آرتريت التهابي وجود عامل روماتوييد (RF) يا آنتيبادي ضد پروتئين سيترولينه (ACPA) يا افزايش پروتئين واکنشي CRP) C) يا سرعت رسوب گلبولهاي قرمز (ESR) به نفع تشخيص آرتريت روماتوييد است. ارزيابي اوليه آزمايشگاهي بايد شامل شمارش کامل سلولهاي خون (CBC) همراه با شمارش افتراقي (diff) و بررسي کارکرد کبد و کليه باشد. بيماراني که داروهاي بيولوژيک دريافت ميکنند بايد از نظر هپاتيت B و C و سل بررسي شوند. تشخيص آرتريت روماتوييد در مراحل اوليه، شروع زودهنگام درمانهاي ضد روماتيسمي تعديلکننده سير بيماري(1) (DMARDها) را امکانپذير ميکند.
ميوپي (نزديکبيني) امروزه در شرق آسيا به دو دليل تبديل به يک مشکل عمده بهداشتي شده است: شيوع بالا و فزاينده آن طي چند دهه گذشته (که امروزه در 90%-80% نوجوانان پس از سن مدرسه ديده ميشود)؛ و پاتولوژيهاي تهديدکننده بينايي که با ميوپي شديد همراهي دارند (و امروزه در 20%-10% نوجوانان پس از پايان دوره دبيرستان ديده ميشوند). روندهاي مشابهي نيز- ولي نه با اين شدت- در ساير نقاط جهان قابل مشاهده است. به نظر ميرسد که شيوع بالاي ميوپي در مناطق شهري شرق آسيا با افزايش فشارهاي تحصيلي و تغييرات در سبک زندگي کودکان (صرف زمان کمتر در محيط بيرون) همراهي داشته باشد. تاکنون ژن مهمي براي ميوپي در سنين مدرسه گزارش نشده است ولي چندين ژن با ميوپي شديد همراهي داشتهاند. دخالت عوامل ژنتيکي در اين تفاوتهاي قومي احتمالا اندک است. با اين حال، هنوز مشخص نيست که سهم ژنهاي فراوان داراي تاثير اندک و يا تعامل ژنتيک و محيط در تفاوتهاي جمعيتي مربوط به ميوپي در سنين مدرسه چقدر است. مداخلات اپتيکال و دارويي نويدبخشي براي پيشگيري از ايجاد ميوپي يا کاهش سرعت پيشرفت آن در دسترس قرار گرفتهاند که البته هنوز نياز به رواسازي بيشتر دارند. در سالهاي اخير همچنين درمانهاي نويدبخشي براي محافظت از بينايي در ميوپيهاي پاتولوژيک معرفي شدهاند.
کمردرد حاد يکي از شايعترين علل مراجعه بزرگسالان به پزشکان خانواده است. اگرچه اکثر مبتلايان به کمردرد به سرعت و با حداقل درمان بهبود پيدا ميکنند، براي شناسايي موارد نادري که در آنها يک پاتولوژي زمينهاي جدي وجود دارد، بايد ارزيابي مناسب انجام شود. کمردرد حاد يکي از شايعترين علل مراجعه بزرگسالان به پزشکان خانواده است. اگرچه اکثر مبتلايان به کمردرد به سرعت و با حداقل درمان بهبود پيدا ميکنند، براي شناسايي موارد نادري که در آنها يک پاتولوژي زمينهاي جدي وجود دارد، بايد ارزيابي مناسب انجام شود. وجود برخي علايم هشدار، لزوم انجام درمان جدي و ارجاع به متخصص ستون فقرات را نشان ميدهد؛ در حالي که وجود برخي علايم ديگر تا به اين اندازه نگرانکننده نيست.
کاهش شنوايي تقريبا يک سوم از بزرگسالان 70-61 سال و بيش از 80% از افراد بالاي 85 سال را درگير ميکند. مردان در مقايسه با زمان معمولا دچار کاهش شنوايي شديدتر و زودرستري ميشوند. شايعترين نوع، کاهش شنوايي مرتبط با سن است با اين حال مشکلات متعددي ميتوانند در هدايت ارتعاشات صوتي به گوش داخلي و تبديل آن به ايميالسهاي الکتريکي منتقل شونده به مغز اختلال ايجاد کنند. غربالگري کاهش شنوايي در بزرگسالان بالاي 60-50 سال توصيه ميشود. آزمونهاي غربالگري قابل انجام در مطب شامل آزمون نجوا اوديوسکوپي (audioscopy) است. بيماران مسني را که به گفته خود دچار اختلال شنوايي هستند ميتوان مستقيما براي انجام اوديوتري ارجاع نمود. با گرفتن شرح حال ميتوان عوامل خطرزاي کاهش شنوايي خصوصا مواجهه صوتي و استفاده از داروهاي اتوتوکسيک را شناسايي نمود. در معاينه مجراي گوش و پرده صماخ ميتوان علل کاهش شنوايي انتقالي را تشخيص داد. براي تاييد کاهش شنوايي به آزمونهاي اوديومتريک نياز است. بزرگسالان مبتلا به کاهش شنوايي ايديوپاتيک ناگهاني بايد براي ارزيابي فوري ارجاع شوند. درمان کاهش شنوايي بر ارزيابي علل زمينهاي خصوصا انسداد (از جمله سرومن گوش) و داروهاي اتوتوکسيک استوار است. شنوايي موجود بايد با استفاده از سمعک، ابزارهاي کمک شنوايي و برنامههاي بازتواني، بهينه شود. ايمپلانتهاي جراحي براي بيماران انتخابي انديکاسيون دارند. موانع عمده براي بهبود شنوايي در افراد مسن شامل اشکال در تشخيص ابتلا به کاهش شنوايي؛ تصور اينکه کاهش شنوايي جزيي طبيعي از فرآيند پيري و غير قابل درمان است؛ و عدم پايبندي بيمار به استفاده از سمعک به دلايلي همچون ترس از انگ خوردن، هزينه، دشواري استفاده، نتايج اوليه نااميد کننده و ساير عوامل هستند.