۳۱ دسامبر ۲۰۱۲- ۱۱ دی ۱۳۹۱
فولیزاک (کروفلمر): سازمان غذا و داروی آمریکا فولیزاک (Fulyzaq) با نام ژنریک کروفلمر (crofelemer) را برای بهبود علائم اسهال در مبتلایان به ایدز که تحت درمان آنتی ویرال قرار دارند مورد تایید قرار داد.
اطلاعات بیشتر
۳۱ دسامبر ۲۰۱۲- ۱۱ دی ۱۳۹۱
سیرتورو (بداکوئیلین): سازمان غذا و داروی آمریکا سیرتورو (Sirturo) با نام ژنریک بداکوئیلین (bedaquiline) را برای درمان سل مقاوم به درمان در بالغین مورد تایید قرار داد.
اطلاعات بیشتر
۲۸ دسامبر ۲۰۱۲- ۸ دی ۱۳۹۱
الیکوئیز (اپیکسابان): سازمان غذا و داروی آمریکا الیکوئیز (Eliquis) با نام ژنریک اپیکسابان (apixaban) را برای پیشگیری از حملات مغزی و آمبولی سیستمیک در بیماران مبتلا به فیبریلاسیون دهلیزی که به دلیل مشکلات دریچه ای ایجاد نشده، مورد تایید قرار داد.
اطلاعات بیشتر
۲۶ دسامبر ۲۰۱۲- ۶ دی ۱۳۹۱
جوکستاپید (لومیتاپید): سازمان غذا و داروی آمریکا جوکستاپید (Juxtapid) با نام ژنریک لومیتاپید (lomitapide) را برای کاهش دادن LDL، کلسترول توتال، آپولیپوپروتئین B و لیژوژروتئین non-HDL در بیماران مبتلا به هیپرکلسترولمی فامیلیال هموزیگوت مورد تایید قرار داد.
اطلاعات بیشتر
۲۱ دسامبر ۲۰۱۲- ۱ دی ۱۳۹۱
واریزیگ: سازمان غذا و داروی آمریکا واریزیگ (Varizig) را برای کاهش شدت عفونت آبله مرغان (ویروس واریسلا زوستر) در افراد پرخطر تا ۴ روز پس از مواجهه مورد تایید قرار داد.
اطلاعات بیشتر
۲۱ دسامبر ۲۰۱۲- ۱ دی ۱۳۹۱
گاتکس (تدوگلوتاید): سازمان غذا و داروی آمریکا گاتکس (Gattex) با نام ژنریک تدوگلوتاید (teduglutide) را برای درمان بالغین دچار نشانگان سندرم روده کوتاه مورد تایید قرار داد.
اطلاعات بیشتر
۱۴ دسامبر ۲۰۱۲- ۲۴ آذر ۱۳۹۱
سیگنیفور (پازیرئوتاید): سازمان غذا و داروي آمريکا (FDA) پازيرئوتايد دياسپارتات(pasireotide diaspartate) با نام تجاري سيگنيفور (Signifor) را براي درمان کوشينگ در بيماراني که جراحي به آنها کمکي نخواهد کرد، مورد تاييد قرار داده است. بيماري کوشينگ به دنبال توليد بيش از حد کورتيزول از غدد آدرنال ايجاد ميشود. وجود تومور در غده هيپوفيز باعث تحريک بيشتر غده آدرنال و در نتيجه توليد بيش از حد کورتيزول ميشود. کورتيزول فعاليتهاي مهمي را در بدن تنظيم ميکند. (از جمله پاسخدهي به استرس و صدمه). مبتلايان به کوشينگ در معرض خطر اضافه وزن، ديابت يا عدم تحمل گلوکز، فشارخون بالا و عفونت هستند. ايمني و اثربخشي سيگنيفور در يک مطالعه باليني با شرکت 162 بيمار مبتلا به کوشينگ مورد بررسي قرار گرفت. شرکتکنندگان در اين مطالعه بهطور تصادفي يکي از دو دوز سيگنيفور را طي 6 ماه درمان دريافت کردند. به برخي از بيماران با پاسخدهي درماني مطلوب اجازه ادامه درمان داده شد. سيگنيفور باعث کاهش سطح کورتيزول در ادرار 24 ساعته ميشود. اين کاهش در يک ماه پس از شروع درمان ديده شد. ميزان کورتيزول ادرار در حدود 20درصد از بيماران تحت مطالعه به سطح طبيعي رسيد. سيگنيفور باعث افزايش سطح قند خون ميشود بنابراين ادامه درمان با اين دارو ممکن است باعث وخيمتر شدن ديابت در برخي از بيماران شود. به همين دليل FDA انجام مطالعات پس از ورود به بازار مصرف را براي اين دارو درخواست کرده است. سيگنيفور 2 بار در روز زير پوست تزريق ميشود.
اطلاعات بیشتر
۱۴ دسامبر ۲۰۱۲- ۲۴ آذر ۱۳۹۱
راکسی باکوماب: سازمان غذا و داروی آمریکا راکسی باکوماب (raxibacumab) را برای درمان سیاه زخم استنشاقی مورد تایید قرار داد.
اطلاعات بیشتر
۱۴ دسامبر ۲۰۱۲
ایکلوسیگ (پوناتینیب): سازمان غذا و داروی آمریکا ایکلوسیگ (Iclusig) با نام ژنریک پوناتینیب (ponatinib) را برای درمان دو بیماری نادر خون و مغز استخوان، لوسمی میلوئید مزمن (CML) و لوسمی لنفوبلاستیک حاد کروکوزوم فیلادلفیا مثبت ((Ph+ ALL) مورد تایید قرار داد.
اطلاعات بیشتر
۹ آذر ۱۳۹۱- ۲۹ نوامبر ۲۰۱۲
کومتریک (کابوزانتينيب): سازمان غذا و داروي آمريکا کابوزانتينيب(Cabozantinib) با نام تجاري کومتريک (Cometriq) را براي درمان بدخيمي متاستاتيک مدولاري تيروييد مورد تاييد قرار داد. بدخيمي مدولاري تيروييد، در سلولهاي توليدکننده هورمون کلسيتونين غده تيروييد ايجاد ميشود. اين نوع سرطان ممکن است بدون هيچ سابقه قبلي يا در خانوادههايي که موتاسيون ژنتيکي خاصي دارند رخ دهد. به دليل اين موتاسيون خاص فرد به يک يا حتي چند بدخيمي سيستم اندوکرين- از جمله بدخيمي مدولاري تيروييد- مبتلا مي شوند. انستيتوي ملي سرطان آمريکا تخمين زده است که براي بيش از 56 هزار آمريکايي در سال 2012 تشخيص بدخيمي تيروييد گذاشته خواهد شد و 18 هزار نفر به دنبال ابتلا به اين بيماري جان خود را از دست خواهند داد. سرطان مدولاري تيروييد حدود 4 درصد از بدخيميهاي تيروييد را شامل ميشود. کومتريک، دومين داروي مورد تاييد FDA براي درمان سرطان مدولاري تيروييد طي 2 سال اخير است. در سال 2011 ميلادي، اين سازمان کاپرلسا (Caprelsa) را براي درمان مبتلايان به بدخيمي نادر مدولاري تيروييد مورد تاييد قرار داده بود. کومتريک، يک مهارکننده کيناز است که پروتئينهاي کيناز غيرطبيعي دخيل در رشد و تکامل بدخيمي سلولهاي مدولاري تيروييد را بلوک ميکند. ايمني و اثربخشي کومتريک در يک مطالعه باليني با شرکت 330 بيمار مبتلا به سرطان مدولاري تيروييد مورد بررسي قرار گرفت. درمان با کومتريک طول مدت زندگي بدون پيشرفت سرطان را کاهش داد و در برخي از اين بيماران اندازه تومور را نيز کوچکتر کرد. در بيماران دريافتکننده کومتريک مدت زمان توقف رشد تومور به طور متوسط 11 ماه و در دريافتکنندگان دارونما 4 ماه بود. در 27درصد از بيماران تحت درمان با کومتريک پس از گذشت 15 ماه از شروع مصرف کاهش اندازه تومور گزارش شد. شايعترين عوارض جانبي کومتريک در مطالعات عبارت بودند از اسهال، التهاب و زخمهاي دهاني، قرمزي و درد در انتهاها (سندرم دست- پا)، کاهش وزن، کاهش اشتها، تهوع، ضعف، دردشکمي و يبوست.
اطلاعات بیشتر
۳۰ آبان ۱۳۹۱- ۲۰ نوامبر ۲۰۱۲
فلوسلواکس: اداره كل غذا و داروي آمريكا واكسن فلوسلواکس (Flucelvax) را كه نخستين واكسن آنفلوآنزاي فصلي است كه به جاي استفاده از تخممرغهاي بارور شده، با كمك سلولهاي كشت داده شده حيواني ساخته شده، مورد تاييد خود قرار داد. اين واكسن براي محافظت در بيماران با حداقل سن 18 سال از آنفلوآنزاي فصلي تاييد شده است. روند ساخت «فلوسلواكس» شبيه واكسنهاي توليد شده قبلي بر مبناي تخممرغ است هر چند وقتي از سلولهاي كشت داده شده حيواني استفاده ميشود، گونههاي ويروس در سلولهايي با منشا پستانداران رشد ميكنند. شركت داروسازي «نوارتيس» كه سازنده اين واكسن جديد است، مدعي است توليد «فلوسلواكس» در محيطي بسته، استريل و كنترل شده انجام شده كه به طور قابلتوجهي خطر ناخالصيهاي بالقوه را كاهش ميدهد و در توليد آن از هيچ ماده نگهدارندهاي استفاده نشده است.
اطلاعات بیشتر
۱۶ آبان ۱۳۹۱- ۶ نوامبر ۲۰۱۲
زلجانز (توفاسيتينيب): سازمان غذا و داروي آمريکا توفاسيتينيب (Tofacitinib) با نام تجاري زلجانز (Xeljans)را براي درمان بزرگسالان مبتلا به نوع متوسط تا شديد آرتريت روماتوييد فعال که پاسخدهي درماني مناسبي به متوترکسات نداشتهاند يا نسبت به آن عدم تحمل پيدا کردهاند مورد تاييد قرار داد. آرتريت روماتوييد، يک بيماري اتوايميون است که در آن سيستم ايمني بدن به اشتباه بافتهاي سالم را مورد هدف قرار ميدهد در نتيجه التهاب مفاصل و بافتهاي اطراف آنها مشاهده ميشود. زلجانز با الگوي 2 بار در روز مصرف ميشود و با بلوک مولکولهاي ژانوز کيناز- که در التهاب مفصل نقش دارند- اعمال اثر ميکند. ايمني و اثربخشي آن در 7 مطالعه باليني با شرکت بزرگسالان مبتلا به نوع متوسط تا شديد آرتريت روماتوييد فعال مورد بررسي قرار گرفت. در تمام اين مطالعات بيماران تحت درمان با زلجانز بهبود پاسخدهي درماني و عملکرد فيزيکي را تجربه کردند. مصرف اين دارو با افزايش خطر ابتلا به عفونتهايي نظير عفونتهاي فرصتطلب (در شرايط مهار سيستم ايمني رخ ميدهند)، توبرکلوز و لنفوم همراه است. همچنين خطر افزايش کلسترول و آنزيمهاي کبدي و افت شمارش سلولهاي خوني وجود دارد. براي آگاهي از آثار درازمدت زلجانز روي بيماريهاي قلبي، بدخيميها و عفونتهاي شديد سازمان غذا و داروي آمريکا مطالعات پس از ورود به بازار براي اين دارو درخواست کرده است.
اطلاعات بیشتر
۵ آبان ۱۳۹۱- ۲۶ اکتبر ۲۰۱۲
سینریب (اوماستاکسین): سازمان غذا و داروي آمريکا (FDA)، اوماستاکسين مپسوکسينات (omacetaxine mepesuccinate) با نام تجاري سينريب (Synribo) را براي درمان لوکمي ميلوژنوس مزمن در بزرگسالان (CML) مورد تاييد قرار داده است. انستيتوي ملي سلامت آمريکا پيشبيني کرده است تا پايان سال 2012 ميلادي 5 هزار و 430 نفر با تشخيصCML روبرو خواهند شد. سينريب در بيماراني که بدخيمي آنها پس از درمان با حداقل دو دارو از گروه مهارکنندههاي تيروزين کيناز پيشرفت کرده، تجويز ميشود. اين دارو پروتئينهاي دخيل در تکامل سلولهاي سرطاني را مهار ميکند و به صورت 2 بار در روز براي مدت 14 روز متوالي زير پوست تزريق ميشود. سپس آن را براي مدت 7 روز مکرر (طي دورههاي 28 روزه) تا زماني که در بيمار بهبود باليني ايجاد ميکند، تجويز ميکنند. داروي جديد در بيماراني که نسبت به ساير داروهاي مورد تاييد FDA در درمان CML فاز مزمن يا فاز شعلهور مقاوم شدهاند يا عدم تحمل دارويي دارند اميد تازهاي است. شايعترين عوارض گزارششده به دنبال مصرف سينريب در بيماران تحت مطالعه عبارت بودند از افت پلاکتها، آنمي، نوتروپني و متعاقب آن عفونت و تب، اسهال، تهوع، ضعف و بيحالي، واکنش محل تزريق و کاهش تعداد لنفوسيتهاي بدن (لنفوپني). اين دارو دومين داروي مورد تاييد FDA طي 2 ماه اخير براي درمان CML است. در سپتامبر سال ميلادي جاري، FDA بوسوليف را براي درمان مبتلايان به CML کروموزوم فيلادلفيا مثبتي که در فاز مزمن، بلاستيک يا پيشرونده بودند و نسبت به ساير داروي موجود مقاوم شده يا عدم تحمل دارويي داشتند مورد تاييد قرار داده بود.
اطلاعات بیشتر
۱ آبان ۱۳۹۱- ۲۲ اکتبر ۲۰۱۲
فیکومپا (پرامپانل): سازمان غذا و داروی آمریکا قرص های پرامپانل با نام تجاری فیکومپا را برای تشنج های پارشیال در بیماران مبتلا به صرع که بیش از 12 سال سن دارند مورد تایید قرار داده است. تشنج های پارشیال، شایع ترین نوع تشنج در مبتلایان به صرع هستند. برخی از مبتلایان به صرع با استفاده از درمان موجود موفق به کنترل مطلوب تشنج ها نمی شوند. نتایج حاصل از 3 مطالعه بالینی بهبود چشمگیری در کنترل تشنج بیماران دریافت کننده فیکومپا در مقایسه با مصرف کنندگان دارونما نشان داده است. شایع ترین عوارض گزارش شده توسط بیماران تحت درمان با فیکومپا در این مطالعات عبارت بودند از گیجی، خواب آلودگی، ضعف، تحریک پذیری، عفونت های مجاری تنفسی فوقانی، افزایش وزن، سرگیجه، آتاکسی، لنگش، عدم تعادل، اضطراب، تاری دید، دیس آرتری، بی حالی، حالت تهاجمی و پرخوابی. در برگه اطلاعات دارویی مربوط به فیکومپا، در مورد خطر جدی مشکلات عصبی روانی نظیر تحریک پذیری، تهاجم، خشم، اضطراب، پارانویا، خلق یوفوریک، بی قراری و تغییر وضعیت روانی هشدار داده شده است. برخی از این مشکلات تا به حدی جدی گزارش شده اند که تهدید کننده حیات بوده اند. در تعداد بسیار محدودی، از بیماران هم رفتارهای خشونت آمیز گزارش شده است. بنابراین به خانواده بیمار توصیه کنید در صورت مشاهده هرگونه تغییر رفتار با پزشک تماس بگیرند و اگر افزایش دوز دارو ضروری است، مانیتورینگ دقیق بیمار فراموش نشود.
اطلاعات بیشتر
۲۷ مهر ۱۳۹۱- ۱۸ اکتبر ۲۰۱۲
ژتریا (اکریپلاسمین): سازمان غذا و داروي آمريکا در اوکريپلاسمين (ocriplasmin) با نام تجاري ژتريا (Jetrea) را به عنوان اولين داروي مورد قبول اين سازمان در درمان چسبندگي علامتدار ويتروماکولار مورد تاييد قرار داده است. چسبندگي علامتدار ويتروماکولار به وضعيتي گفته ميشود که در آن زجاجيه شروع به حرکت در مقابل ماکولا کرده است. همانطور که ميدانيد ماکولا بخشي از شبکيه است که مسوول بينايي شناخته ميشود. چنين وضعيتي ميتواند به تخريب ماکولا- به دنبال کشيدگي و فشردگي- بينجامد. ژتريا آنزيمي است که پروتئينهاي مسبب چسبندگي علامتدار ويتروماکولار را ميشکند. تخريب اين پروتئينها باعث جداشدن بهتر زجاجيه و ماکولا ميشود و ميتواند خطر وقوع کشيدگي را کاهش دهد. درمان ديگر براي اين عارضه، جراحي است. با تاييد داروي اخير، گزينه درماني غيرجراحي براي غلبه بر چسبندگي علامتدار ويتروماکولار در اختيار متخصصان قرار ميگيرد. اثربخشي و ايمني ژتريا در 2 مطالعه باليني با شرکت 652 بيمار مبتلا به چسبندگي علامتدار ويتروماکولار مورد بررسي قرار گرفت. بيماران به طور کاملا تصادفي تحت درمان با تزريق تک دوز ژتريا به درون چشم يا تزريق دارونما قرار گرفتند. بيماران در 28 روز بعد از تزريق و سپس 6 ماه بعدي از لحاظ تظاهر هر گونه عارضه باليني بررسي شدند. شايعترين عوارض گزارششده به دنبال درمان با ژتريا عبارت بودند از خونريزي ملتحمه، درد چشم، مشاهده جرقههاي نور، تاري ديد، ديد ناواضح، افت بينايي، ادم شبکيه و ماکولا.
اطلاعات بیشتر
۷ مهر ۱۳۹۱- ۲۸ سپتامبر ۲۰۱۲
هومیرا (آدالیموماب): سازمان غذا و داروي آمريکا هومیرا (Humira) با نام ژنریک آدالیموماب (adalimumab) را برای درمان کولیت اولسراتیو متوسط تا شدید در بزرگسالان مورد تایید قرار داد.
اطلاعات بیشتر
۶ مهر ۱۳۹۱- ۲۷ سپتامبر ۲۰۱۲
استیوارگا (رگورافنیب): سازمان غذا و داروي آمريکا رگورافنيب (regorafenib) با نام تجاري استيوارگا(Stivarga) را براي درمان مبتلايان به بدخيمي کولورکتال متاستاتيک مورد تاييد قرار داده است. استيوارگا يک مهارکننده مولتي کيناز است که آنزيمهاي متعدد دخيل در پيشرفت بدخيمي را مهار ميکند. اين دارو يک ماه قبل از موعد مقرر براي اعلام نتيجه بررسيها، از سوي سازمان غذا و داروي آمريکا تاييد شد. استيوارگا دومين داروي مورد تاييد از سوي FDA طي 2 ماه گذشته است. براساس آمار ارائه شده از سوي اداره کنترل و پيشگيري از بيمارهاي آمريکا، بدخيمي کولورکتال سومين سرطان شايع ميان مردان و زنان است. اثربخشي و ايمني استيوارگا در يک مطالعه باليني با شرکت 760 بيمار تحت درمان با تشخيص بدخيمي کولورکتال متاستاتيک بررسي شد. بيماران به طور تصادفي استيوارگا يا دارونما دريافت کردند. مصرف استيوارگا يا دارونما تا زمان عود بدخيمي يا غيرقابل تحمل شدن عوارض ادامه يافت. نتايج نشان دادند درمانشدگان با استيوارگا در مقايسه با دريافتکنندگان دارونما طول عمر بيشتري داشتند. همچنين زمان تاخير در رشد تومور در دريافتکنندگان استيوارگا به طور متوسط 2 ماه بيشتر بود. شايعترين عوارض گزارششده از سوي بيماران تحت درمان با استيوارگا عبارت بودند از ضعف و بيحالي، کاهش اشتها، نشانگان دست – پا(اريتروديس استازي کف دست و پا)، اسهال، زخمهاي دهان(موکوزيت)کاهش وزن، عفونت، افزايش فشارخون، ديس فوني(تغيير صدا).
اطلاعات بیشتر
۲۲ شهریور ۱۳۹۱- ۱۲ سپتامبر ۲۰۱۲
اوباجيو (تريفلونومايد): سازمان غذا و داروي آمريکا اوباجيو (Aubagio) را براي درمان مولتيپل اسکلروزيس موردتاييد قرار داد. قرص اوباجيو، با نام تجاري تريفلونومايد (teriflunomide) به شکل يکبار در روز در بزرگسالان مبتلا به نوع عودکننده بيماري اماس تجويز ميشود. در مطالعات باليني، ميزان عود در بيماران مصرفکننده اوباجيو 30 درصد کمتر از دريافتکنندگان دارونما بود. شايعترين عوارض جانبي مشاهده شده به دنبال مصرف اوباجيو در مطالعات مذکور عبارت بودند از اسهال، غيرطبيعي بودن آزمونهاي عملکرد کبدي، تهوع و ريزش مو. به دليل خطر بروز مشکلات کبدي بايد قبل و طي مصرف اوباجيو آزمونهاي عملکرد کبدي بيمار مرتب کنترل شود. اماس، بيمارياي است که حرکت، احساس و ادراک بيمار را تحتتاثير قرار ميدهد، بنابراين وجود گزينههاي درماني کارآمد براي کنترل آن بسيار اهميت دارد. در اين بيماري التهابي اتوايميون دستگاه عصبي مرکزي، ارتباط ميان مغز و ساير اعضاي بدن مختل ميشود. اماس از جمله شايعترين علل نورولوژيک ناتواني در بزرگسالان جوان است و در مردان 2 برابر بيشتر از زنان بروز مييابد. در اغلب مبتلايان به اماس، اپيزودهاي شعلهوري و اپيزودهاي بهبود(فروکش) بيماري به دنبال هم رخ ميدهند.
اطلاعات بیشتر
۱۴ شهریور ۱۳۹۱- ۴ سپتامبر ۲۰۱۲
بسوليف (بسوتينيب): سازمان غذا و داروي آمريکا بسوليف (Bosulif)با نام ژنريک بسوتينيب (bosutinib) را براي درمان لوسمي ميلوژنوس مزمن (CML) که نوعي بيماري خون و مغز استخوان در بزرگسالان است مورد تاييد قرار داد. پيشبيني ميشود تا پايان سال 2012 ميلادي براي 5430 زن و مرد تشخيص CML گذاشته شود. بيشتر مبتلايان به CML يک موتاسيون ژنتيکي(کروموزوم فيلادلفيا)دارند که باعث ميشود مغز استخوان آنزيمي با نام تيروزين کيناز بسازد. اين آنزيم باعث تشکيل مقادير زيادي سلولهاي سفيد خوني غيرطبيعي (گرانولوسيتها) ميشود. بسوليف در مبتلايان به CMLمزمن، در فاز پيشرونده يا بلاست کروموزوم فيلادلفيا مثبت که نسبت به ساير داروها مقاوم شدهاند يا عدم تحمل دارند تجويز ميشود. بسوليف با بلوک سيگنالهاي تيروزين کيناز که باعث شکلگيري گرانولوسيتهاي غيرطبيعي در بيمار ميشود اعمال اثر ميکند. ساير داروهايي که از سوي سازمان غذا و داروي آمريکا براي درمانCML مورد تاييد قرار گرفتهاند عبارتند از ايماتينيب در سال 2001 ، دازاتينيب در سال 2006 و نيلوتينيب در سال 2007 ميلادي. ايمني و اثربخشي بسوليف در يک مطالعه باليني با شرکت 546 بيمار بزرگسال در مرحله مزمن، پيشرونده يا بلاست CML بررسي شد. در همه آنها CML به دنبال مصرف ايماتينيب و در مرحله بعدي نيلوتينيب يا دازاتينيب پيشرفت کرده بود. در مرحله نهايي تمام آنها تحت درمان با بسوليف قرار گرفتند.
اطلاعات بیشتر
۱۰ شهریور ۱۳۹۱- ۳۱ آگوست ۲۰۱۲
تاندی (انزالوتاماید)
اطلاعات بیشتر
۹ شهریور ۱۳۹۱- ۳۰ آگوست ۲۰۱۲
لینزس (لیناکلوتاید)
اطلاعات بیشتر
۶ شهریور ۱۳۹۱- ۲۷ آگوست ۲۰۱۲
استريبيلد (الويتگراوير، کوبيسيستات، امتريسيتابين و تنوفووير): سازمان غذا و داروي آمريکا قرص ترکيبي استريبيلد (Stribild) که شامل الويتگراوير، کوبيسيستات، امتريسيتابين و تنوفووير ديسوپروکسيل فومارات است را براي درمان عفونت HIV-1 در بزرگسالاني که براي عفونت خود هرگز تحت درمان قرار نگرفتهاند مورد تاييد قرار داد. در قرص ترکيبي استريبيلد دو داروي مورد استفاده در درمان اچآيوي که قبلا مورد تاييد FDA قرار گرفته بودند همراه دو داروي جديد الويتگراوير و کوبيسيستات وجود دارد. الويتگراوير، دارويي است که يکي از آنزيم هاي مورد نياز ويروس ايدز براي تکثير را مهار ميکند. کوبيسيستات، آنزيمي را مهار ميکند که متابوليزهکننده داروهاي ضدايدز است و براي طولانيتر کردن اثر الويتگراوير تجويز ميشود. ترکيب امتريسيتابين و تنوفووير ديسوپروکسيل فومارات در سال 2004 ميلادي با عنوان ترووادا (Truvada) مورد تاييد قرار گرفته بود. ترووادا فعاليت آنزيم ديگري را که ويروس ايدز براي تکثير در بدن بيماران نياز دارد، بلوک ميکند. در مجموع اين ترکيبات دارويي رژيم درماني کاملي براي عفونت اچآيوي فراهم ميکند. به دنبال تحقيقات جديد و گسترش توليد داروهاي ضدايدز، درمان ايدز از رژيمهاي چندقرصي به رژيمهاي تکقرصي تغيير شکل داده است. تاييد استريبيلد از سوي سازمان غذا و داروي آمريکا، گامي در جهت سادهتر کردن درمان ايدز است. استريبيلد، جديدترين داروي مورد تاييد FDA در سال ميلادي جاري است. ايمني و اثربخشي آن روي 1408 بيمار بزرگسال که قبلا تحت درمان قرار نگرفته بودند در دو مطالعه باليني دوسوکور مورد ارزيابي قرار گرفت. شايعترين عوارض مشاهده شده به دنبال مصرف استريبيلد طي اين مطالعه عبارت بودند از تهوع و اسهال.
اطلاعات بیشتر
۲۰ مرداد ۱۳۹۱- ۱۰ آگوست ۲۰۱۲
لوسنتیس (رانيبيزوماب): رانيبيزوماب ranibizumab با نام تجاري لوسنتيس Lucentis از سوي سازمان غذا و داروي آمريکا براي درمان ادم ماکولاي ديابتيک كه يک بيماري چشمي در مبتلايان به ديابت است و باعث تاري ديد، از دست رفتن بينايي و گاه کوري ميشود، موردتاييد قرار گرفت. هم اکنون ديابت علت اصلي موارد جديد کوري در آمريکاست و تخمين زده شده ادم ماکولاي ديابتيک بيش از 560 هزار آمريکايي را گرفتار کرده است. لوسنتيس نخستين و تنها داروي مورد تاييد FDA براي درمان ادم ماکولاي ديابتيک است. استانداردهاي جهاني درمان اين عارضه طي 25 سال گذشته تغييري نکرده است. تاکنون درمان استاندارد ادم ماکولاي ديابتيک در آمريکا جراحي با ليزر بود که روند کاهش بينايي را کند کرده و وضعيت بينايي را تثبيت ميکند اما در بازگرداندن بينايي از دست رفته چندان توانا نيست. تاييد رسمي اين دارو پيشرفت مهمي در مبارزه عليه کوري در مبتلايان به ديابت است و اين دارو زندگي مبتلايان به ادم ماکولاي ديابتيک را متحول ميکند. لوسنتيس 5/0 ميليگرم ماهانه اولين بار توسط FDA براي درمان دژنراسيون مرتبط با سن ماکولاي مرطوب در سال 2006 ميلادي مورد تاييد قرار گرفت. تاييد آن براي درمان ادم ماکولاي متعاقب انسداد وريد شبکيه در سال 2012 انجام شد. لوسنتيس 3/0 ميليگرم ماهانه براي درمان ادم ماکولاي ديابتيک مورد تاييد قرار گرفته و از 15 آگوست در بازار مصرف قرار خواهد داشت. تاييد لوسنتيس در درمان ادم ماکولاي ديابتيک براساس مطالعات فاز 3 ژننتک با نامهاي رايد RIDE و رايز RISE صورت گرفت. در اين دو مطالعه مجموع 759 بيمار به طور تصادفي در 3 گروه قرار گرفتند و ماهانه درمان با 3/0 ميليگرم لوسنتيس (250 نفر)، 5/0 ميليگرم لوسنتيس (252 نفر) يا دارونما (گروه کنترل شامل 257 نفر)را تجربه کردند. نتايج نشان دادند که دريافت کنندگان لوسنتيس 3/0 ميليگرمي طي 7 روز بهبود و طي 24 ماه پايداري در بينايي را تجربه کردند. بيشتر بيماران تحت درمان با لوسنتيس توانستند پس از گذشت 24 ماه دست کم 3 خط بيشتر از جدول ارزيابي چشم را بخوانند (درمطالعه رايد، 34 درصد در گروه دريافت کننده 3/0 ميليگرم لوسنتيس در برابر 12 درصد در گروه شاهد و در مطالعه رايز، 45درصد در دريافت کنندگان 3/0 ميليگرم لوسنتيس در برابر 18 درصد گروه شاهد.)
اطلاعات بیشتر
۱۹ مرداد ۱۳۹۱- ۹ آگوست ۲۰۱۲
مارکیبو (وينکريستين سولفات): سازمان غذا و داروي آمريکا محلول تزريقي ليپوزوم وينکريستين سولفات بانام تجاري مارکيبو (Marqibo) را براي تجويز در مبتلايان به لوکمي لنفوبلاستيک حاد کروموزوم فيلادلفيا منفي مورد تاييد قرار داد. لوکمي لنفوبلاستيک حاد شکلي نادرازبدخيمي خون و مغز استخوان است که در ميان کودکان شايعتر از بالغان است. براساس آمار اعلام شده از سوي انستيتو ملي سرطان در آمريکا، در سال جاري براي 6050 مرد و زن تشخيص لوکمي لنفوبلاستيک حاد گذاشته خواهد شد و 1440 نفر در اين سال جان خود را بر اثر ابتلا به اين بيماري از دست خواهند داد. تجويز مارکيبو در بيماراني مورد تاييد قرار گرفته که لوکمي حداقل 2بار عود کرده يا لوکمي آنها پس از استفاده از 2 يا تعداد بيشتري رژيم هاي درماني ضد لوکمي وخيم تر شده است. مارکيبو حاوي وينکريستين، يک داروي متداول ضدسرطان است و يکبار در هفته تجويز مي شود. به گفته ريچارد پازدور، سرپرست اداره داروهاي هماتولوژي و انکولوژي مرکز تحقيق و ارزيابي داروهاي FDA ، مارکيبو گزينه درماني تاز هاي براي مبتلايان به نوع فيلادلفيا منفي لوکمي لنفوبلاستيک حاد است که بيماريشان به درما ن هاي موجود پاسخ نداده است. مارکيپو تحت برنامه حمايت از داروهاي مورد استفاده براي درمان بيماري هاي نادرمورد تاييد قرار گرفته است. اثربخشي دارو در يک مطالعه رو يبالغان مبتلا به لوکمي لنفوبلاستيک حاد که با وجود به رهگيري از درما ن هاي استاندارد بيماري آنها حداقل 2 بار عود کرده بررسي شده ا ست. هدف از مطالعه تعيين ميزان پاسخدهي به مارکيبو بود. از ميان 65 بيمار شرکت کننده در اين مطالعه، 10 بيمار (15 درصد) پاسخدهي درماني کامل داشتند و متوسط زمان تا اولين عود، مرگ يا درمان بعدي 56 روز بود. ايمني مارکيبو در 2 مطالعه با شرکت 83 بيمار مورد بررسي قرار گرفت. عوارض جانبي شديد نظير افت گلبولهاي سفيد همراه با تب، افت فشارخون، ديسترس تنفسي و ايست قلبي در 76 درصد از بيماران مشاهده شد.
اطلاعات بیشتر
۱۳ مرداد ۱۳۹۱- ۳ آگوست ۲۰۱۲
زالتراپ (زيوافليبرسپت): سازمان غذا و داروي آمريکا زيوافليبرسپت (zivaflibercept) با نام تجاري زالتراپ را براي تجويز همراه با رژيم شيمي درماني فولفيري (شامل اسيد فوليک، فلورواوراسيل و ايرينوتکان) براي درمان بزرگسالان با بدخيمي کولورکتال مورد تاييد قرار داد. زالتراپ يک مهارکننده آنژيوژنز است که خونرساني به تومورها را مهار ميکند. اين دارو بهخصوص براي بيماراني که بدخيمي آنها به ساير اعضاي بدن دستاندازي کرده و نيز آن گروه بيماراني که تومورهاي آنها به رژيم شيميدرماني حاوي اگزالي پلاتين(oxaliplatin) مقاوم است، تجويز ميشود. بدخيمي کولورکتال از نظر شيوع در رتبه چهارم بدخيميها در ايالات متحده قرار دارد. براساس پيشبيني انستيتوي ملي سلامت، در سال 2012 ميلادي براي 143460 نفر از مردم اين کشور تشخيص بدخيمي کولورکتال گذاشته خواهد شد و 51690 نفر در اين سال متعاقب ابتلا به بدخيمي نامبرده جان خود را از دست خواهند داد. اثربخشي و ايمني زالتراپ در يک مطالعه باليني روي 1226 بيمار با بدخيمي کولورکتال متاستاتيک که بيماري آنها طي دريافت رژيم کموتراپي حاوي اگزالي پلاتين وخيمتر يا بدخيمي آنها با جراحي برداشته شده اما طي 6 ماه پس از شيميدرماني با اگزالي پلاتين متعاقب جراحي عود کرده بود، بررسي شد. شرکتکنندگان در مطالعه تا زمان وخيمتر شدن بدخيمي يا غيرقابل تحمل شدن عارضه دارو درمان را ادامه دادند. شايعترين عوارض جانبي مشاهده شده در دريافتکنندگان زالتراپ همراه با فولفيري عبارت بودند از کاهش تعداد گلبولهاي سفيد، اسهال، زخمهاي دهاني، ضعف، افزايش فشارخون، کاهش وزن، کم شدن اشتها، درد شکمي و سردرد.
اطلاعات بیشتر
۲ مرداد ۱۳۹۱- ۲۳ جولای ۲۰۱۲
تودورزا پرساير (اکليدينيوم برومايد): سازمان غذا و داروي آمريکا اکليدينيوم برومايد(aclidinium bromide) با نام تجاري تودورزا پرساير (Tudorza Pressair) را براي درمان نگهدارنده طولانيمدت برونکواسپاسم (تنگي مجاري هوايي در شش) مرتبط با بيماري مزمن انسدادي ريه از جمله آمفيزم و برونشيت مزمن مورد تاييد قرار داده است. بيماري مزمن انسدادي ريه مشکلي جدي براي سلامت است و هم اکنون چهارمين علت مرگ در آمريکا محسوب ميشود. تودورزا پرساير، يک پودر خشک استنشاقي است که به صورت 2بار در روز مصرف ميشود. اين داروي آنتيموسکاريني طولاني اثر باعث شل شدن عضلات مجاري هوايي ريوي و در نتيجه بهبود جريان هوا ميشود. بيماري مزمن انسدادي ريه در طول زمان رو به وخامت ميرود، بنابراين در دسترس بودن داروهاي طولاني اثر براي درمان نگهدارنده اين گروه بيماريها، به ميليونها بيماري که از اين عارضه رنج ميبرند کمک خواهد کرد. ايمني و اثربخشي تودورزا پرساير در 3مطالعه باليني با استفاده از دارونما روي 1276 بيمار بالاي 40 سال با تشخيص باليني بيماري مزمن انسدادي ريه مورد بررسي قرار گرفت.
اطلاعات بیشتر
۳۰ تیر ۱۳۹۱- ۲۰ جولای ۲۰۱۲
کیپرولیس (کارفیلزومیب)
اطلاعات بیشتر
۲۷ تیر ۱۳۹۱- ۱۷ جولای ۲۰۱۲
پرپوپيک: سازمان غذا و داروي آمريکا پرپوپيک (Prepopik) که شامل پيکوسولفات سديم، مگنزيم اکسايد و آنهيدروز سيتريک اسيد است را براي آماده کردن کولون در بالغان پيش از کولونوسکوپي مورد تاييد قرار داده است. يک دوز پرپوپيک متشکل از دو پاکت پودر است که هر کدام در آب سرد حل و جداگانه مصرف ميشوند. بيماران بايد پرپوپيک را شب قبل از کولونوسکوپي و صبح روز کولونوسکوپي دريافت کنند(رژيم دوز مجزا). اگر چنين اقدامي ميسر نبود، بيماران بايد پرپوپيک را بعدازظهر و عصر روز قبل از کولونوسکوپي مصرف کنند(رژيم روز قبل). نوشيدن مايعات اضافي طي و پس از دريافت پرپوپيک بخشي از اين رژيم درماني است. به علاوه نوشيدن مايعات اضافي خطر بههم خوردن تعادل آب و الکتروليت را به حداقل ميرساند. شايعترين عوارض گزارششده در بالغان دريافتکننده پرپوپيک عبارتند از تهوع، استفراغ و سردرد.
اطلاعات بیشتر
۲۶ تیر ۱۳۹۱- ۱۶ جولای ۲۰۱۲
ترووادا (امتریسیتابین/تنوفوویر دیزوپروکسیل فومارات): سازمان غذا و داروي آمريکا، ترووادا (Truvada)-شامل امتريسيتابين و تنوفووير ديزوپروکسيل فومارات-به عنوان اولين داروي مورد تاييد براي کاستن از خطر عفونت اچآيوي در افراد آلوده نشده که مستعد هستند و ممکن است همسر آنها آلوده به اچآيوي باشد، مورد تایید قرار داد. ترووادا به صورت روزانه به عنوان پروفيلاکسي پيش از مواجهه، براي کم کردن احتمال عفونت اچآيوي متعاقب تماس جنسي در افراد در معرض خطر تجويز ميشود. ترووادا پيش از اين در ترکيب با ساير داروهاي ضدويروس براي درمان بالغان آلوده به اچآيوي و کودکان بالاي 12 سال تاييد شده بود.
اطلاعات بیشتر
۸ تیر ۱۳۹۱- ۲۸ ژوئن ۲۰۱۲
ميربتريک (ميرابگرون): اخيرا سازمان غذا و داروي آمريکا ميرابگرون (mirabegron) با نام تجاري ميربتريک (Myrbetriq) را براي درمان مثانه بيشفعال در بالغان موردتاييد قرار داده است. مثانه بيشفعال عارضهاي است که در آن عضلات مثانه از کنترل خارج شده و بيش از حد لازم يا به طور ناگهاني منقبض ميشوند. قرصهاي با الگوي مصرف يکبار در روز ميربتريک آهسته رهش، قابليت ذخيرهسازي ادرار در مثانه را با شل کردن عضلات آن بهبود ميبخشد. علايم مثانه بيشفعال عبارتند از تکرر ادرار، احساس نياز فوري به دفع ادرار و خروج غيرارادي ادرار(بياختياري ادرار). هماکنون حدود 33 ميليون نفر از مردم آمريکا از مثانه بيشفعال رنج ميبرند. اثربخشي و ايمني ميرابگرون در 3 مطالعه باليني دوسوکور چند مرکزي با استفاده از دارونما مورد ارزيابي قرار گرفت. مجموع 4116 بيمار با مثانه بيشفعال به طور تصادفي تحت درمان با دوزهاي 25، 50، 100 ميليگرم ميرابگرون يکبار در روز يا دارونما براي مدت 12 هفته قرار گرفتند. نتايج مطالعه نشان داد ميرابگرون 25 و 50 ميليگرمي در کاهش تعداد دفعات نياز بيمار به دفع ادرار و نيز تعداد دفعاتي که بيمار دفع غيرارادي ادرار را تجربه ميکند موثر بوده است.
اطلاعات بیشتر
۷ تیر ۱۳۹۱- ۲۷ ژوئن ۲۰۱۲
بلويک (یورکاسرین هیدروکلراید): سازمان غذا و داروي آمريکا داروي بلويک (Belviq) را به عنوان درمان همراه با رژيم غذايي کم کالري و افزايش فعاليت هاي ورزشي، براي کنترل وزن در بالغ ها با شاخص توده بدن برابر يا بيشتر ازkg/m2 30 (مبتلايان به چاقي) يا BMI 27 (افراد با اضافه وزن) در صورتي که همراه با يکي از بيماري هاي مرتبط با چاقي (نظير افزايش فشارخون، اختلالات سوخت وساز چربي به ويژه کلسترول بالا،ديابت نوع دو) باشد، مورد تاييد قرار داده است. اثربخشي و ايمني تجويز همزمان بلويک و ساير محصولات ارائه شده در بازار دارويي با هدف کاهش وزن و نيز عوارض قلبي-عروقي و مرگ و مير متعاقب مصرف اين دارو هنوز بررسي نشده است.به علاوه، اثربخشي و ايمني بلويک در کودکان و نوجوانان کمتر از 18 سال نامشخص است. بلويک يک داروي نسخه اي است که به بالغ هاي چاق يا مبتلا به اضافي وزن که به طور همزمان به بيماري هاي مرتبط با چاقي دچار هستند در کنترل وزن کمک مي کند. اين دارو فعال سازي گيرنده سروتونين 2C در مغز باعث احساس سيري پس از مصرف حجم غذايي اندک در افراد مي شود.
اطلاعات بیشتر
۲۵ خرداد ۱۳۹۱- ۱۴ ژوئن ۲۰۱۲
منهيبريکس: سازمان غذا و داروي آمريکا منهيبريکس (Menhibrix) که يک واکسن ترکيبي براي نوزادان و کودکان 6 هفته تا 18 ماهه است را براي پيشگيري از بيماري تهاجمي ناشي از سروتايپ Y,C نايسريا منينژايتيديس و تيپ B هموفيلوس آنفلوانزا مورد تاييد قرار داده است. بيماريهاي ايجاد شده توسط نايسريا منينژايتيديس (يعني مننژيت مننگوکوکي) و تيپ B هموفيلوس آنفلوانزا ميتوانند کشنده باشند. اين باکتريها ممکن است وارد خون شده و باعث سپسيس شوند يا از پرده محافظتکننده از مغز و نخاع بگذرند و مننژيت ايجاد کنند. در کودکان خردسال، عفونت با نايسريا منينژايتيديس و تيپ B هموفيلوس آنفلوانزا به دليل احتمال ايجاد مننژيت باکتريايي بسيار خطرناک هستند. در صورت عدم واکسيناسيون، کودکان کوچکتر از 2 سال مستعد ابتلا به اين بيماريهاي جدي هستند. دو عفونت نامبرده بسيار خطرناکند؛ زيرا به سرعت پيشرفت ميكنند و ممکن است به عوارض دايمي (نظير کوري، عقب افتادگي ذهني يا قطع عضو)، حتي مرگ منتهي شوند. متاسفانه علايم ابتلا به عفونت ناشي از هر دو باکتري ذکرشده در اغلب موارد با ساير عفونتهاي رايج اما بيخطر دوران کودکي اشتباه گرفته ميشوند. ايمني منهيبريکس روي بيش از 7500 نوزاد و شيرخوار در آمريکا، مکزيک و استراليا موردبررسي قرار گرفته است. شايعترين عوارض تزريق اين واکسن در مطالعات انجام شده عبارت بودند از درد، قرمزي و تورم محل تزريق و تب.
اطلاعات بیشتر
۱۹ خرداد ۱۳۹۱- ۸ ژوئن ۲۰۱۲
پرجتا (پرتوزوماب): سازمان غذا و داروي آمريکا پرتوزوماب (pertuzumab) با نام تجاري پرجتا (Perjeta) را براي تجويز در مبتلايان به بدخيمي متاستاتيک پستان HER2 مثبت مورد تاييد قرار داده است. پرجتا به عنوان درمان همراه با تراستوزوماب (trastuzumab) و دوستاکسل در مبتلايان به بدخيمي متاستاتيک پستان HER2 مثبت که قبلا درمان ضد HER2 يا کموتراپي دريافت نکردهاند، تجويز ميشود. اين تاييد سازمان غذا و داروي آمريکا براساس يافتههاي به دست آمده از يک مطالعه فاز 3 انجام شده است. در اين مطالعه بيماران HER2 مثبت که قبلا تحت درمان دارويي نبودهاند، ترکيب درماني پرجتا، هرسپتين و دوستاکسل را دريافت کردند. اين گروه در مقايسه با ساير بيماران 6 ماه بيشتر عمر کردند. در حالي که بيماران محروم از درمان دارويي، با وخيمتر شدن بيماري روبرو بودند. ترکيب درماني پرجتا، هرسپتين و شيميدرماني تنها رژيم درماني است که در مقايسه با درمان با هرسپتين و شيميدرماني بهبود قابلتوجهي در وضعيت بيماران بدون سابقه درمان با ضد HER2 ايجاد ميکند. پرجتا، دارويي اختصاصي است که گيرنده HER2 را هدف قرار ميدهد. HER2 يک پروتئين است که به ميزان فراواني در خارج از سلولها در بدخيميهاي HER2 مثبت يافت ميشود. چنين تصور ميشود که پرجتا مکملي براي هرسپتين است زيرا اين دو دارو مناطق متفاوتي را در گيرنده HER2 هدف قرار ميدهند.
اطلاعات بیشتر
۱۲ اردیبهشت ۱۳۹۱- ۱ می ۲۰۱۲
الليسو (تاليگلوسراز آلفا): سازمان غذا و داروي آمريکا (FDA)، تاليگلوسراز آلفا (Taliglucerase alfa) تزريقي با نام تجاري الليسو (Elelyso) را براي درمان بيماري گوچر (Gaucher Disease) مورد تاييد قرار داده است. اين دارو، يک آنزيمدرماني جايگزين (ERT) براي درمان درازمدت بزرگسالان با تشخيص قطعي بيماري گوچر نوع يک است. الليسو، نخستين آنزيمدرماني جايگزين بر پايه سلول گياهي مورد تاييد سازمان غذا و داروي آمريکا براي بيماري گوچر است. همچنين، الليسو اولين داروي بهدست آمده از سلول گياهي مورد تاييد اين سازمان است که با کمک مهندسي ژنتيک از سلولهاي هويج مشتق شده است. الليسو، شکلي از آنزيم ليزوزومال انساني، گلوکوسربروزيدازاست که براي درمان بيماري گوچر مورد استفاده قرار ميگيرد. مانند هر داروي پروتئيني داخل وريدي، در مورد آنزيمدرماني جايگزين نيز احتمال واکنشهاي آلرژيک شديد (از جمله آنافيلاکسي)در بيماران تحت درمان با الليسو وجود دارد. به علاوه، واکنشهاي مرتبط با اينفيوژن (از جمله واکنشهاي آلرژيک) که به واکنشهاي بروز يافته طي 24 ساعت اول اينفيوژن گفته ميشود، شايعترين عوارض مشاهده شده در مطالعات مرتبط به الليسو محسوب ميشود. شايعترين واکنشهاي مرتبط به اينفيوژن الليسو عبارت بودند از سردرد، دردقفسه سينه، ضعف و بيحالي، کهير، قرمزي غيرطبيعي پوست، افزايش فشارخون، دردکمر و مفاصل و گرگرفتگي. بيشتر اين واکنشها خفيف بودند و نيازي به درمان نداشتند. مديريت درمان واکنشهاي ناشي از اينفيوژن الليسو براساس نوع و شدت اين واکنشها صورت ميگيرد. همانند ساير پروتئينهاي درماني، در مورد آنزيمدرماني جايگزين نيز احتمال توليد آنتيباديها عليه الليسو وجود دارد. بيماري گوچر در افرادي که به ميزان کافي از آنزيم گلوکوسربروزيداز توليد نميکنند بروز ميکند. کمبود اين آنزيم باعث ميشود چربيها در طحال، کبد، کليهها و ساير اعضاي بدن تجمع يابند. علايم اصلي بيماري گوچر عبارتند از آسيب کبد يا طحال، آنمي، افت پلاکتها و مشکلات استخواني. در کشور ايالات متحده حدود 6 هزار نفر از نوع يک بيماري گوچر رنج ميبرند.
اطلاعات بیشتر
۸ اردیبهشت ۱۳۹۱- ۲۷ آپریل ۲۰۱۲
استندرا (آوانافیل): سازمان غذا و داروي آمريکا داروبي جديد با نام ژنريک آوانافيل (Avanafil) و نام تجاري استندرا (Stendra) را براي درمان اختلال نعوظ تاييد كرده است. حدود 30 ميليون نفر از مردان آمريکايي دچار اختلال نعوظ هستند. «استندرا» قرصي است که بيماران بايد نيم ساعت قبل از نياز آن را مصرف کنند. بهتر است اين دارو در حداقل دوز لازم براي بيمار تجويز شود. استندرا به گروه دارويي مهارکنندههاي فسفودي استراز نوع 5 متعلق است. مکانيسم اثر استندرا مانند ساير مهارکنندههاي فسفودي استراز نوع 5، افزايش جريان خون در عضو است. مهارکنندههاي فسفودي استراز نوع 5 ممکن است تغيير در ديد رنگي ايجاد کنند. در موارد نادري، از دست رفتن ناگهاني ديد يک يا هر دو چشم را در مردان مصرفکننده مهارکنندههاي فسفودي استراز نوع 5 گزارش کردهاند. افت يا کاهش شنوايي نيز در برخي از بيماران مشاهده شده است. شايعترين عوارض ناخواسته مصرف استندرا که در بيش از 2 درصد بيماران تحت مطالعات باليني گزارش شدهاند عبارتند از: سردرد، قرمزي صورت (گرگرفتگي)، احتقان بيني، سندرم شبهسرماخوردگي و دردکمر. اثربخشي و ايمني استندرا در سه مطالعه دوسوکور با استفاده از دارونما بررسي شده است. مجموع 1267بيمار به طور کاملا تصادفي استندرا را براي مدت 2 هفته در دوزهاي 50، 100 يا 200 ميليگرمي يا دارونما دريافت کردند.
اطلاعات بیشتر
۷ اردیبهشت ۱۳۹۱- ۲۶ آپریل ۲۰۱۲
وترینت (پازوپانايب): سازمان غذا و داروي آمريکا (FDA)، پازوپانايب (Pazopanib) با نام تجاري وترينت (Votrient) را براي درمان مبتلايان به سارکوم پيشرفته بافت نرم در آن گروه از بيماران که قبلا کموتراپي دريافت کرده بودند، مورد تاييد قرار داده است. سارکوم بافت نرم نوعي سرطان خوشخيم بافت عضلاني، چربي، فيبروز و ساير بافتهاست. قرص وترينت با دخالت در آنژيوژنز- شکلگيري عروق خوني جديد براي رشد و بقاي تومورهاي جامد- اعمال اثر ميکند. سارکوم بافت نرم، نوعي نادر از سرطان است که سالانه حدود 10 هزار مورد از آن در ايالاتمتحده اتفاق ميافتد. بيش از 20 نوع سارکوم در مطالعه بالينياي که به تاييد وترينت انجاميد، شرکت داشتند. وترينت براي تجويز در بيماران با سارکوم آديپوسيتيک بافت نرم و تومورهاي استرومال دستگاه گوارش مورد تاييد نيست. ايمني و اثربخشي وترينت در يک مطالعه باليني با شرکت 369 بيمار با سارکوم پيشرفته بافت نرم که قبلا تحت شيميدرماني قرار گرفته بودند، بررسي شد. به اين بيماران بهطور تصادفي وترينت يا دارونما داده شد. معيار اثربخشي اين مطالعه، طول زماني بود که بيمار بدون پيشرفت بدخيمي به زندگي ادامه ميداد. در دريافتکنندگان وترينت شانس بقاي بدون بيماري بهطور متوسط 6-4 ماه و در گروه تحت درمان با دارونما اين رقم 6-1 ماه بود. شايعترين عوارض جانبي در دريافتکنندگان وترينت عبارت بودند از ضعف، اسهال، تهوع، کاهش وزن، افزايش فشارخون، کاهش اشتها، استفراغ، درد عضلاني، تغيير رنگ مو، سردرد، تغيير رنگ پوست، تنگي نفس و اختلال در حس چشايي. وترينت اولين بار در اکتبر 2009 ميلادي براي درمان بدخيمي پيشرفته کليه مورد تاييد سازمان غذا و داروي آمريکا قرار گرفته بود.
اطلاعات بیشتر
۲۲ فروردین ۱۳۹۱- ۱۰ آپریل ۲۰۱۲
آمیوید: سازمان غذا و داروي آمريکا (FDA)، آميويد(Amyvid) –يک داروي تشخيصي راديواکتيو براي تصويربرداري از پلاکهاي بتاآميلوييد در بيماران با اختلالات شناختي به دنبال ابتلا به بيماري آلزايمر و ساير دلايل افت مهارتهاي شناختي- را مورد تاييد قرار داده است. آميويد به پلاکهاي آميلوييد که وجه تشخيص بيماري آلزايمر هستند، متصل ميشود و در نتيجه در تصاوير اسکن مغزي رويت ميشوند. اسکن آميويد مثبت نشاندهنده حضور متوسط تا متناوب پلاکهاي آميلوييد است که اين ميزان پلاک آميلوييد در مبتلايان به آلزايمر مشاهده ميشود اما ممکن است در بيماران با ساير بيماريهاي نورولوژيک و نيز در سالمندان با وضعيت شناختي طبيعي همين ميزان پلاک وجود داشته باشد. بايد به خاطر داشت آميويد يک روش کمکي و همراه براي ساير روشهاي تشخيصي است و يک اسکن آميويد مثبت به معناي تشخيص قطعي بيماري آلزايمر يا ساير اختلالات شناختي نيست. به علاوه ايمني و اثربخشي آميويد در پيشبيني ميزان پيشرفت دمانس يا ساير بيماريهاي نورولوژيک يا حتي مانيتورکردن پاسخدهي درماني ارزيابي نشده است.
اطلاعات بیشتر
۸ فروردین ۱۳۹۱- ۲۷ مارس ۲۰۱۲
امنتیس (پگینزاتاید): پگینزاتاید (peginesatide) با نام تجاری امنتیس (Omontys) برای درمان کم خونی در بیماران بزرگسال دیالیزی که مبتلا به بیماری مزمن کلیوی (CKD) هستند مورد تایید قرار گرفته است.
اطلاعات بیشتر
۱۹ مارس ۲۰۱۲
بونیوا (ایباندرونات): ایباندرونات (Ibandronate) با نام تجاری بونیوا (Boniva)، یک محصول با مصرف ماهیانه یک بار، برای درمان یا پیشگیری از پوکی استخوان در زنان بعد از یائسگی مورد تایید قرار گرفته است.
اطلاعات بیشتر
۱۴ مارس ۲۰۱۲
لکساپرو (اس سیتالوپرام): اس سیتالوپرام (Escitalopram) با نام تجاری لکساپرو (Lexapro) برای درمان افسردگی و اضطراب منتشر در بزرگسالان مورد تایید قرار گرفته است.
اطلاعات بیشتر
۶ مارس ۲۰۱۲
سورفاکسین (لوسیناکتانت): لوسیناکتانت (lucinactant) با نام تجاری سورفاکسین (Surfaxin) برای پیشگیری از سندرم دیسترس تنفسی (RDS) در نوزادان نارس مورد تایید قرار گرفته است. ریه نوزادان نارس قادر به تولید کافی سورفاکتانت، مایعی که سطوح داخلی ریه ها را می پوشاند و کمک می کند تا آن ها را باز نگه دارد، نمی باشد. بدون سورفاکتانت کافی ریه ها جمع شده و نوزاد تنفس سختی دارد. اغلب کودکانی که مبتلا به RDS می شوند، نشانه های تنفس مشکل و فقدان اکسیژن را در بدو تولد یا در عرض چند ساعت اول تولد از خود نشان می دهند. سورفاکسین پنجمین داروی تایید شده در آمریکا جهت درمان RDS در نوزادان نارس می باشد. سایر سورفاکتانت های تایید شده شامل سوروانتا (براکتانت)، کوروسورف (پوراکتانت آلفا)، اینفاسورف (کالفاکتانت) و اگزوسورف (کولفوسکریل پالمیتات) می باشد.
اطلاعات بیشتر
۲۹ فوریه ۲۰۱۲
فلومیست: فلومیست (FluMist) اولين واكسني است كه افراد را در برابر 4 گونه آنفلوآنزاي رايج محافظت ميكند. اين واكسن يك لايه محافظتي اضافي در برابر ويروس آنفلوآنزا ايجاد ميكند. اين واكسن كه واكسن كوادري والانت FluMist ناميده ميشود در برابر 2 گونه آنفلوآنزاي A و 2 گونه آنفلوآنزاي B سد محافظتي دارد. FDA واكسن اسپريشكل آن را براي افراد 2 تا 49 سال تاييد كرده است. تمام واكسنهاي قبلي آنفلوآنزا حاوي 2 گونه آنفلوآنزاي A و يك گونه آنفلوآنزاي B است كه سالانه توسط متخصصان امر براساس گونههايي كه در محيط وجود دارند، انتخاب ميشوند. اين واكسن جديد كه گونه اضافي آنفلوآنزاي B را در خود جاي داده، احتمال محافظت بيشتري را در برابر آنفلوآنزا افزايش ميدهد. يك واكسن جديد هم مانند نوع قبلي FluMist به شكل اسپري بيني است كه گونههاي ضعيفشده ويروس را تحويل ميدهد. بیماری ناشی از ویروس آنفلوانزا B بر کودکان، به ویژه نوجوانان در سنین مدرسه، تاثیر می گذارد. شدت بیماری و مرگ ناشی از آنفلوآنزا به طور گسترده ای از فصلی به فصل دیگر متفاوت است. بین سال های 1976 و 2007، مرگ و میر مربوط به آنفولانزا بین 3هزار تا 49 هزار نفر برآورد شده است.
اطلاعات بیشتر
۱۷ فوریه ۲۰۱۲
کورلیم (میفه پریستون): ميفه پريستون (Mifepristone) با نام تجاري کورليم (Korlym) براي کنترل ميزان قند خون (هايپرگليسمي) در بزرگسالان مبتلا به سندرم کوشينگ درون زاد مورد تا ييد قرار گرفته است. اين دارو براي مبتلايان به سندرم کوشينگ درون زاد که به ديابت نوع 2 نيز مبتلايند ولي کانديد مناسبي براي جراحي نيستند يا کساني که به درمان جراحي قبلي پاسخ خوبي نداده اند تجويز خواهد شد. پيش از تاييد کورليم از سوي سازمان غذا و داروي آمريکا، درمان دارويي تاييد شده اي براي سندرم کوشينگ درون زاد وجود نداشت. سندرم کوشينگ درون زاد يک اختلال جدي، ناتوان کننده و نادر چندسيستمي است. اين سندرم به دليل توليد بيش از حد کورتيزول (هورمون استرو ييدي که سطح قندخون را افزايش مي دهد) توسط غدد فوق کليوي ايجاد مي شود و بيش از همه، بزرگسالان 25 تا 40 سال را درگير مي کند. هم اکنون بيش از 5 هزار بيمار کانديدای درمان با کورليم هستند. اين دارو در سال 2007 ميلادي توسط سازمان غذا و داروي آمريکا در زمره داروهاي اورفان قرار گرفت. کورليم اتصال کورتيزول به گيرنده اش را مسدود مي کند. هر چنداين دارو توليد کورتيزول را کاهشن مي دهد،اما آثار کورتيزول اضافي (نظير سطوح بالاي قندخون) را کاهش مي دهد. اثربخشي و ايمني کورليم در مبتلايان به سندرم کوشينگ درون زاد در يک مطالعه باليني با شرکت 50 بيمار بررسي شد. شايعترين عوارض مشاهده شده در ميان بيماران تحت درمان با کورليم عبارت بودند از تهوع، ضعف، سردرد، آرترالژي، استفراغ، ادم اندام ها، گيجي و کاهش اشتها. تجويز کورليم در زنان باردار ممنوعيت دارد.
اطلاعات بیشتر
۱۴فوریه ۲۰۱۲
زیوپتان (محلول چشمی تافلوپروست): زيوپتان (Zioptan) که محلول چشمي تافلوپروست (Tafluprost Ophtalmic Solution) 0015/0 درصد است مورد تاييد قرار گرفته است. زيوپتان اولين آنالوگ پروستاگلندين به شکل محلول چشمي و بدون ماده نگهدارنده است که مورد تاييد اين سازمان قرار ميگيرد. قابليت زيوپتان در کاهش فشار داخل چشمي در مبتلايان به گلوکوم زاويه باز يا مبتلايان به فشارخون بالاي چشمي است. گلوکوم زاويه باز شايعترين نوع گلوکوم و فشارخون بالاي چشمي، عارضهاي است که با افزايش فشار داخل چشمي تشخيص داده ميشود. به گفته جرج ال.اسپات، از مرکز بيماريهاي چشم فيلادلفيا، آنالوگهاي پروستاگلندين اغلب به عنوان خط اول درمان براي کاهش فشار داخل چشمي در مبتلايان به گلوکوم زاويه باز تجويز ميشوند. بنابراين تاييد زيوپتان از سوي سازمان غذا و داروي آمريکا گزينه درماني تازه و موثرتري در کاهش فشار داخل چشمي در اختيار چشمپزشکان قرار ميدهد. پيشبيني ميشود زيوپتان به زودي براي درمان بيماران زيادي مورد استفاده قرار گيرد. زيوپتان ممکن است تغييراتي در مژههاي چشم تحت درمان با اين دارو ايجاد کند. اين تغييرات شامل افزايش طول، رنگ، ضخامت، شکل و تعداد مژههاست. تغييرات ايجاد شده در مژهها بهطور معمول پس از قطع مصرف دارو برگشتپذيرند. مواردي از تغيير در بافتهاي پيگمانته متعاقب مصرف زيوپتان گزارش شده است. شايعترين اين تغييرات عبارت بودند از افزايش پيگمانتاسيون عنبيه، بافت اطراف چشم (پلک) و مژهها. انتظار ميرود با ادامه مصرف زيوپتان پيگمانتاسيون افزايش يابد. به نظر ميرسد پس از قطع مصرف زيوپتان پيگمانتاسيون عنبيه دايمي است، در حالي که پيگمانتاسيون بافت اطراف چشم و پلکها برگشتپذير گزارش شده است. تاييد زيوپتان توسط سازمان غذا و داروي آمريکا براساس 5 مطالعه انجام شده روي 905 بيمار در فاصله زماني 2 سال بود. در اين مطالعات اثربخشي و ايمني هر دو فرمولاسيون حاوي ماده نگهدارنده و بدون ماده نگهدارنده تافلوپروست مورد بررسي قرار گرفت. چنين نتيجهگيري شد که زيوپتان در مقايسه با شکل ديگر تافلوپروست در کاهش فشار داخل چشمي موثرتر است. در اين مطالعات دو ساله، مصرف روزانه زيوپتان در ماه سوم مصرف 6 تا 8 ميليمتر جيوه و در ماه ششم 5 تا 8 ميليمتر جيوه ميزان فشار داخل کره چشم را کاهش داد. (فشار پايه داخل چشمي 26-23 ميليمتر جيوه). شرکت «مرک» پيشبيني کرده است زيوپتان در ماه مارس ميلادي سال جاري در بازار دارويي موجود خواهد بود.
اطلاعات بیشتر
۳۱ ژانویه ۲۰۱۲
گلیوک (ایماتینیب): گليوک (Gleevec) با نام ژنريک «ايماتينيب مسيلات» (Imatinib mesylate) جهت درمان موارد جديدي از بيماريها مورد تاييد اين اداره قرار دارد. این دارو برای استفاده در بیماران بزرگسال پس از عمل جراحی تومور استرومال دستگاه گوارش CD117 مثبت يا GIST مورد تایید قرار گرفته است. در تاییدیه جدید اعلام شده بقای کلی بیماران در صورتی که دارو را به مدت ۳۶ ماه مصرف کنند نسبت به زمانی که دوره استاندارد ۱۲ ماهه درمان را بگیرند افزایش می یابد. گليوک که اول بار در سال 2001 توسط FDA مورد تاييد قرار گرفت، يکي از نخستين داروهايي است که براي بلوک کردن ارتباطات سلولي استفاده ميشود و نتيجه آن، جلوگيري از رشد مجدد تومور است. عوارض جانبي آن عبارتاند از: اسهال، خستگي، تهوع و موارد ديگر.
اطلاعات بیشتر
۳۱ ژانویه ۲۰۱۲
کالیدکو (ایواکافتور): ایواکافتور (Ivacaftor) با نام تجاری کالیدکو (Kalydeco) برای درمان شکل نادری از بیماری سیستیک فیبروزیس در بیماران ۶ سال به بالا که مبتلا به موتاسیون G551D ژن تنظیم کننده داخل غشایی سیستیک فیبروزیس (CFTR) هستند مورد تایید قرار گرفته است. کاليدکو، پروتئين ناقص مسبب فيبروز را هدف قرار ميدهد. کاليدکو اولين درماني است که علت ايجادکننده فيبروز کيستيک را برطرف ميکند. هدف از توليد کاليدکو بهبود کيفيت زندگي مبتلايان به فيبروز کيستيک است. فيبروز کيستيک، ناشي از نقصان يا فقدان پروتئينهاي CFTR متعاقب موتاسيون در ژن CFTR است. وجود نداشتن پروتئينهاي CFTR عملکردي باعث جريان ضعيف نمک و آب از خلال ديواره سلولي در اعضايي نظير ريهها ميشود. در نتيجه موکوس غليظ و چسبندهاي توليد ميکند که باعث عفونتهاي مزمن ريوي و تخريب پيشرونده ريه ميشود.
اطلاعات بیشتر
۳۰ ژانویه ۲۰۱۲
اریوج (ویزمودژیب): ويزمودجيب (Vismodegib) با نام تجاري اريوج (Erivedge) براي درمان کارسينوم سلول بازال در بزرگسالان مورد تاييد قرار گرفته است. تجويز اريوج براي بيماراني انجام ميشود که براي جراحي يا راديوتراپي کانديد مناسبي نيستند يا بدخيمي آنها به ساير اعضاي بدن تهاجم يافته است. اريوج، اولين داروي موردتاييد سازمان غذا و داروي آمريکا براي درمان کارسينوم سلول بازال متاستاتيک است. کارسينوم سلول بازال معمولا شکلي بدون درد و با پيشرفت کند از بدخيمي پوست است که در سطحيترين لايه پوست ظاهر ميشود. اين نوع بدخيمي معمولا در مناطقي از پوست که در معرض نورآفتاب هستند بروز ميکند. اريوج با شکل قرص يکبار مصرف موجود است. اثربخشي و ايمني اين دارو در يک مطالعه باليني روي 96 بيمار با کارسينوم سلول بازال متاستاتيک يا پيشرفته مورد بررسي قرار گرفته است. شايعترين عوارض ناشي از مصرف اريوج در بيماران تحتمطالعه عبارت بودند از گرفتگيهاي شديد عضلاني، ريزش مو، کاهش وزن و از بين رفتن قدرت درک طعمها در ناحيه زبان. در برگه اطلاعات دارويي اريوج، در مورد خطر مرگ يا نقايص مادرزادي کشنده در جنين هشدار داده شده است. از بيماران با کارسينوم سلول بازال متاستاتيک دريافت کننده اريوج، 30 درصد پاسخ دهي نسبي و 43 درصد از بيماران بدون متاستاز ولي در مرحله پيشرفته بيماري، پاسخ دهي درماني کامل يا نسبي نشان دادند.
اطلاعات بیشتر
۲۷ ژانویه۲۰۱۲
اینلیتا (آکسیتینیب): آکسيتينيب (Axitinib)با نام تجاري اينليتا (Inlyta) براي درمان مبتلايان به بدخيمي پيشرفته کليه (کارسينوم سلول کليوي) که به ساير داروهاي متداول در درمان اين نوع بدخيمي پاسخ ندادهاند مورد تاييد قرار گرفته است. اينليتا فعاليت خود را با بلوک پروتئينهاي خاصي که کينازها ناميده ميشوند، اعمال ميکند. کينازها نقش مهمي در رشد تومور و پيشرفت بدخيمي ايفا ميکنند. اينليتا به شکل قرص است و بيمار روزانه دوبار بايد آن را مصرف کند. براساس گفته سرپرست مرکز تحقيق و ارزيابي داروهاي سازمان غذا و داروي آمريکا، اينليتا هفتمين دارويي است که از سال 2005 ميلادي تاکنون براي درمان بدخيمي پيشرفته يا متاستاتيک سلولهاي کليوي مورد تاييد قرار گرفته و وارد بازار شده است. ساير داروهاي مورد تاييد براي درمان بدخيمي مذکور عبارتند از سورافنايب (Sorafenib)، سانيتينايب (Sunitinib)،تمسيروليموس (Temsirolimus)، اوروليموس (Everolimus)، بواسيزوماب (Bevacizumab)و پازوپانايب(Pazopanib). اثربخشي و ايمني اينليتا در يک مطالعه تصادفي چندمرکزي روي 723 بيمار که بدخيمي آنها پس از حداقل يک درمان پيشرفتهتر شده بود بررسيشد. اين مطالعه براي تخمين ميزان شانس بقاي بدون پيشرفت بيماري ترتيب داده شد.
اطلاعات بیشتر
۱۷ ژانویه ۲۰۱۲
ووراکساز (گلوکارپیداز): گلوکارپيداز (Glucarpidase) با نام تجاري ووراکساز (Voraxaze) براي درمان مسموميت با متوترکسات موردتاييد قرار گرفته است. متوترکسات يک داروي شيميدرماني است که بهطور معمول کليهها آن را از بدن دفع ميکنند، اما دريافتکنندگان متوترکسات ممکن است بهدنبال وجود سطوح سمي اين دارو در جريان خون خود دچار نارسايي کليوي شوند. ووراکساز آنزيمي است که به سرعت سطوح خوني متوترکسات را با شکستن داروي کموتراپي به شکل قابلدفع آن، از بدن حذف ميکند. ووراکساز به صورت داخل وريدي تجويز ميشود و از داروهاي اورفان است؛ يعني در شمار داروهايي قرار دارد که براي درمان بيماريهاي خاص يا نادر تجويز ميشوند. در يک مطالعه باليني با شرکت 22 بيمار اثربخشي ووراکساز بررسي شد. تمام اين بيماران ووراکساز دريافت کردند. در اين مطالعه افت متوترکسات به زير سطوح بحراني طي 15 دقيقه پس از تجويز دارو و باقي ماندن آن در همان وضعيت براي مدت 8 روز، موفقيت درماني درنظر گرفته شد. 10 نفر از 22 بيمار به اين استاندارد تعريفشده درماني دستيافتند. هر چند تمام بيماران به نتيجه درماني مذکور نرسيدند، اما ووراکساز توانست تا 95 درصد ميزان متوترکسات را در همه بيماران کاهش دهد. يک مطالعه باليني مجزا نيز ايمني داروي ووراکساز را در 290 بيمار با مشکلهاي کليرانس متوترکسات از جريان خون بررسي کرد. شايعترين عوارض جانبي مشاهده شده در بيش از يک درصد از جمعيت بيماران در مطالعات باليني عبارت بود از پايينبودن فشارخون(افت فشارخون)، سردرد، تهوع، استفراغ، گرگرفتگي و پاراستزي. ووراکساز(گلوکارپيداز)، يک آنزيم کاربوکسي پپتيداز است که براي درمان غلظتهاي سمي متوترکسات (بيش از يک ميکرومول در ليتر) در بيماران با کليرانس تاخيري متوترکسات ناشي از اختلال عملکرد کليهها تجويز ميشود.
اطلاعات بیشتر

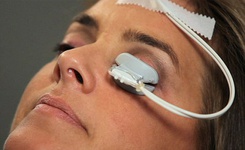 محققان دستگاهی طراحی کردهاند که در یک روش درمانی نوین، با اعمال فشار ملایم و گرما بر روی پلک، می تواند به تسکین و درمان عارضه خشکی چشم کمک کند. مایع اشک باعث مرطوب و تمیز نگه داشتن بخش جلویی چشم در هنگام پلک زدن می شود و عارضه خشکی چشم بدلیل کاهش این مایع روی می دهد که در اینحالت چشم دچار سوزش، خارش و التهاب می شود. عارضه خشکی چشم با افزایش سن و کاهش سطح فعالیت غدد چربی بدن، بیشتر می شود. در 65 درصد موارد، خشکی چشم ناشی از کاهش روند تولید چربی توسط غدد میبومین است؛ این چربی شفاف میبوم (meibum) نام دارد که از تبخیر فیلم آبکی روی چشم جلوگیری می کند، اما در بیماران دچار عارضه خشکی چشم این غدد بدلیل تشکیل چربی دچار گرفتگی می شوند. برای رفع گرفتگی غدد و حذف چربی ها از کمپرس گرم استفاده می شود؛ شستن پلک با شامپو بچه، پاک کردن پلک با گوش پاک کن و رژیم غذایی حاوی امگا-3 نیز بسیار مفید هستند.
محققان دستگاهی طراحی کردهاند که در یک روش درمانی نوین، با اعمال فشار ملایم و گرما بر روی پلک، می تواند به تسکین و درمان عارضه خشکی چشم کمک کند. مایع اشک باعث مرطوب و تمیز نگه داشتن بخش جلویی چشم در هنگام پلک زدن می شود و عارضه خشکی چشم بدلیل کاهش این مایع روی می دهد که در اینحالت چشم دچار سوزش، خارش و التهاب می شود. عارضه خشکی چشم با افزایش سن و کاهش سطح فعالیت غدد چربی بدن، بیشتر می شود. در 65 درصد موارد، خشکی چشم ناشی از کاهش روند تولید چربی توسط غدد میبومین است؛ این چربی شفاف میبوم (meibum) نام دارد که از تبخیر فیلم آبکی روی چشم جلوگیری می کند، اما در بیماران دچار عارضه خشکی چشم این غدد بدلیل تشکیل چربی دچار گرفتگی می شوند. برای رفع گرفتگی غدد و حذف چربی ها از کمپرس گرم استفاده می شود؛ شستن پلک با شامپو بچه، پاک کردن پلک با گوش پاک کن و رژیم غذایی حاوی امگا-3 نیز بسیار مفید هستند. دانشمندان موسسه تحقیقات پزشکی کوئینزلند موفق به ابداع راهی برای استفاده از ویروس اچآیوی علیه اچآیوی در آزمایشگاه شدهاند که از پیشرفت آن برای تبدیل به ایدز جلوگیری میکند. این محققان نشان دادهاند که چگونه یک پروتئین در این ویروس را اصلاح کرده تا در عوض یک نوع حفاظت قوی و ماندگار در برابر عفونت را ارائه کند. پروتئین «Nullbasic» با تغییر یک پروتئین اچآیوی ابداع شده است و از قابلیتهای چشمگیری برای توقف تکثیر ویروس در محیط آزمایشگاه برخوردار است. انتظار میرود که کارآزماییهای حیوانی در سال جاری آغاز شود. تولید موفق این نوع درمان همچنین میتواند کاربردهای اقتصادی نیز داشته باشد. بیماران مبتلا به ایدز در حال حاضر از یک رژیم دارویی برای بقیه دوران زندگی خود استفاده میکنند که میتواند یک بار مالی چشمگیر باشد. این پژوهش در مجله Human Gene Therapy منتشر شده است.
دانشمندان موسسه تحقیقات پزشکی کوئینزلند موفق به ابداع راهی برای استفاده از ویروس اچآیوی علیه اچآیوی در آزمایشگاه شدهاند که از پیشرفت آن برای تبدیل به ایدز جلوگیری میکند. این محققان نشان دادهاند که چگونه یک پروتئین در این ویروس را اصلاح کرده تا در عوض یک نوع حفاظت قوی و ماندگار در برابر عفونت را ارائه کند. پروتئین «Nullbasic» با تغییر یک پروتئین اچآیوی ابداع شده است و از قابلیتهای چشمگیری برای توقف تکثیر ویروس در محیط آزمایشگاه برخوردار است. انتظار میرود که کارآزماییهای حیوانی در سال جاری آغاز شود. تولید موفق این نوع درمان همچنین میتواند کاربردهای اقتصادی نیز داشته باشد. بیماران مبتلا به ایدز در حال حاضر از یک رژیم دارویی برای بقیه دوران زندگی خود استفاده میکنند که میتواند یک بار مالی چشمگیر باشد. این پژوهش در مجله Human Gene Therapy منتشر شده است. یک بیمار انگلیسی مبتلا به سرطان به عنوان اولین فرد در جهان در فرآیندی که به باور پزشکان میتواند یک دستاورد بزرگ برای درمان این بیماری باشد، موفق به کاشت یک پمپ در بدن خود شد. به ادعای متخصصان، این تجربه میتواند نقش مهمی را در زندگی هزاران بیمار سرطانی ایفا کند. این پمپ برای خلاصی از مایع خطرناک ساخته شده در بسیاری از سرطانها طراحی شده که میتواند منجر به نیاز به مراجعه کمتر بیمار به بیمارستان شود. در طولانی مدت امید است که این دستگاه بتواند پیگیری شیوههای تغییر سرطان را تسهیل کرده تا پزشکان بتوانند با درمانهای جدید واکنش نشان دهند.
یک بیمار انگلیسی مبتلا به سرطان به عنوان اولین فرد در جهان در فرآیندی که به باور پزشکان میتواند یک دستاورد بزرگ برای درمان این بیماری باشد، موفق به کاشت یک پمپ در بدن خود شد. به ادعای متخصصان، این تجربه میتواند نقش مهمی را در زندگی هزاران بیمار سرطانی ایفا کند. این پمپ برای خلاصی از مایع خطرناک ساخته شده در بسیاری از سرطانها طراحی شده که میتواند منجر به نیاز به مراجعه کمتر بیمار به بیمارستان شود. در طولانی مدت امید است که این دستگاه بتواند پیگیری شیوههای تغییر سرطان را تسهیل کرده تا پزشکان بتوانند با درمانهای جدید واکنش نشان دهند.

 محققان دانشگاه چالمرز سوئد ایمپلنت جدیدی طراحی کرده اند که از طریق ارسال ارتعاش بداخل استخوان جمجمه، میتواند شنوایی را به بیماران مبتلا به مشکلات گوش میانی باز گرداند. ایمپلنت انتقال استخوانی (BCI) برای مبتلایان به عفونت مزمن گوش خارجی یا میانی، بیماران دچار مشکلات استخوانی گوش، ناهنجاری مادرزادی گوش خارجی، کانال شنوایی یا گوش میانی کاربرد دارد. اندازه ایمپلنت BCI کمتر از شش سانتی متر است که در پشت گوش در زیر پوست سطح جمجمه قرار داده می شود. این دستگاه مجهز به پردازنده صدای خارجی است که صدا را از محیط اطراف دریافت می کند؛ یک سیم پیچ (کویل) القایی درون ایمپلنت امکان دریافت صدای منتقل شده از طریق پوست (از داخل پردازنده) را فراهم می کند. با استفاده از یک بلندگوی مینیاتوری، ارتعاشات صدا داخل استخوان جمجمه بازپخش شده و به گوش داخلی می رسد. آزمایش بالینی ایمپلنت BCI بر روی بیماران دچار مشکلات گوش میانی بزودی آغاز می شود و انتظار می رود که این محصول ظرف یک تا دو سال آینده در اختیار بیماران قرار گیرد.
محققان دانشگاه چالمرز سوئد ایمپلنت جدیدی طراحی کرده اند که از طریق ارسال ارتعاش بداخل استخوان جمجمه، میتواند شنوایی را به بیماران مبتلا به مشکلات گوش میانی باز گرداند. ایمپلنت انتقال استخوانی (BCI) برای مبتلایان به عفونت مزمن گوش خارجی یا میانی، بیماران دچار مشکلات استخوانی گوش، ناهنجاری مادرزادی گوش خارجی، کانال شنوایی یا گوش میانی کاربرد دارد. اندازه ایمپلنت BCI کمتر از شش سانتی متر است که در پشت گوش در زیر پوست سطح جمجمه قرار داده می شود. این دستگاه مجهز به پردازنده صدای خارجی است که صدا را از محیط اطراف دریافت می کند؛ یک سیم پیچ (کویل) القایی درون ایمپلنت امکان دریافت صدای منتقل شده از طریق پوست (از داخل پردازنده) را فراهم می کند. با استفاده از یک بلندگوی مینیاتوری، ارتعاشات صدا داخل استخوان جمجمه بازپخش شده و به گوش داخلی می رسد. آزمایش بالینی ایمپلنت BCI بر روی بیماران دچار مشکلات گوش میانی بزودی آغاز می شود و انتظار می رود که این محصول ظرف یک تا دو سال آینده در اختیار بیماران قرار گیرد. نتایج پژوهشهای جدید نشان داد که خوردن بلوبری و توت فرنگی میتواند خطر وقوع حمله قلبی در زنان را کاهش دهد. محققان دانشگاه هاروارد و دانشگاه آنجلیا با انجام یک مطالعه روی 93600 زن 25 تا 42 ساله و بررسی رژیم غذایی آنها طی 18 سال دریافتند خوردن حداقل 3 وعده توت فرنگی و بلوبری خطر وقوع حمله قلبی در زنان را به میزان یک سوم کاهش میدهند. محققان افزودند زنانی که در این مطالعه بیشترین میزان بلوبری و توت فرنگی را در ماه خورده بودند نسبت به زنانی که یکبار در ماه یا کمتر از این میوهها بهره برده بودند خطر بروز حملات قلبی و عروقی را در خود تا 32 درصد کاهش داده بودند و این یافتهها مستقل از سایر عوامل خطرزا برای ابتلا به حملات قلبی عروقی مانند سن، جنس، فشارخون بالا، سابقه خانوادگی، توده بدنی، ورزش، مصرف سیکار و الکل و کافئین بوده است.
نتایج پژوهشهای جدید نشان داد که خوردن بلوبری و توت فرنگی میتواند خطر وقوع حمله قلبی در زنان را کاهش دهد. محققان دانشگاه هاروارد و دانشگاه آنجلیا با انجام یک مطالعه روی 93600 زن 25 تا 42 ساله و بررسی رژیم غذایی آنها طی 18 سال دریافتند خوردن حداقل 3 وعده توت فرنگی و بلوبری خطر وقوع حمله قلبی در زنان را به میزان یک سوم کاهش میدهند. محققان افزودند زنانی که در این مطالعه بیشترین میزان بلوبری و توت فرنگی را در ماه خورده بودند نسبت به زنانی که یکبار در ماه یا کمتر از این میوهها بهره برده بودند خطر بروز حملات قلبی و عروقی را در خود تا 32 درصد کاهش داده بودند و این یافتهها مستقل از سایر عوامل خطرزا برای ابتلا به حملات قلبی عروقی مانند سن، جنس، فشارخون بالا، سابقه خانوادگی، توده بدنی، ورزش، مصرف سیکار و الکل و کافئین بوده است. پژوهش جدید دانشکده پزشکی هاروارد نشان داده که برداشتن تخمدان زنان منجر به افزایش خطر زوال روانی در سنین پیری میشود. این فرآیند که یک یائسگی ناشی از جراحی را ایجاد میکند، اغلب به دلیل سرطان بر روی زنان جوان انجام میشود و معمولا با برداشتن رحم موسوم به هیسترکتومی نیز همراه است. دانشمندان، 1837 زن سنین 53 تا 100 سال را بررسی کردند که یک سوم آنها تجربه یائسگی ناشی از جراحی را داشتند.
پژوهش جدید دانشکده پزشکی هاروارد نشان داده که برداشتن تخمدان زنان منجر به افزایش خطر زوال روانی در سنین پیری میشود. این فرآیند که یک یائسگی ناشی از جراحی را ایجاد میکند، اغلب به دلیل سرطان بر روی زنان جوان انجام میشود و معمولا با برداشتن رحم موسوم به هیسترکتومی نیز همراه است. دانشمندان، 1837 زن سنین 53 تا 100 سال را بررسی کردند که یک سوم آنها تجربه یائسگی ناشی از جراحی را داشتند. نتایج یک تحقیق انجام شده نشان می دهد که ترک سیگار برخلاف تصور افراد سیگاری، باعث کاهش استرس و بهبود خلق و خو می شود. افراد سیگاری بر این باورند که ترک سیگار در دراز مدت باعث افزایش عصبانیت آنها می شود و در مقابل سیگار کشیدن استرس آنها را کاهش می دهد. این درحالی است که بر اساس مطالعه منتشر شده در یک نشریه انگلیسی روانپزشکی، این یک باور نادرست است که به اشتباه در بین سیگاری ها رواج یافته است.
نتایج یک تحقیق انجام شده نشان می دهد که ترک سیگار برخلاف تصور افراد سیگاری، باعث کاهش استرس و بهبود خلق و خو می شود. افراد سیگاری بر این باورند که ترک سیگار در دراز مدت باعث افزایش عصبانیت آنها می شود و در مقابل سیگار کشیدن استرس آنها را کاهش می دهد. این درحالی است که بر اساس مطالعه منتشر شده در یک نشریه انگلیسی روانپزشکی، این یک باور نادرست است که به اشتباه در بین سیگاری ها رواج یافته است. 