..:::: شناسايي مقاومت سلولهاي سرطاني به داروهاي شيميدرماني از طريق ايمپديمتري ::::..
سلولهاي سرطاني مقاوم به داروهاي شيميدرماني از نظر ويژگيهاي ديالکتريکي با سلولهاي سرطاني غير مقاوم تفاوتهاي قابلتوجهي دارند. پژوهشگران سوئيسي در يک مطالعه جديد مشخص کردند اين تفاوتهاي ديالکتريکي حداقل تا حدودي به علت بيشتر بودن اکتين F در درون اين سلولهاست که باعث قويتر بودن ساختار اين سلولها ميشود. به همين دليل اين پژوهشگران اين فرضيه را مورد آزمايش قرار دارند که آيا با استفاده از روش سختينگاري ميتوان سلولهاي مقاوم به داروهاي شيميدرماني را از سلولهاي سرطاني غيرمقاوم افتراق داد.
نتايج اين مطالعه نشان داد نوعي ارتباط کمي بين ميزان سختي سلولي و غلظت داروهاي شيميدرماني در درون سلولهاي سرطاني وجود دارد. در واقع با افزايش سختي سلولي در تصويربرداري سختينگاري، غلظت داروهاي شيميدرماني در درون سلولهاي سرطاني کاهش پيدا ميکند. به همين دليل اين پژوهشگران پيشنهاد کردند از سختينگاري ميتوان براي ارزيابي نيمه کمّي مقاومت سلولهاي سرطاني به داروهاي شيميدرماني با قراردادن تنها تعدادي ميکروالکترود در اطراف تومور استفاده کرد. اين روش با توجه به غيرتهاجمي بودن ميتواند در تعديل دوز داروهاي شيميدرماني در هر بيمار براساس ميزان مقاومت سلولهاي توموري هر بيمار کمک بسزايي نمايد.
 محققان کلینیک مایو، مکانیسم چگونگی کارآمدکردن نانوذرات طلا علیه سلولهای سرطان تخمدان را شناسایی کردند. نانوذرات طلای باردار مثبت، معمولا برای سلولها سمی هستند، اما سلولهای سرطانی از مسمومشدن توسط آنها، اجتناب میکنند. مطالعه جدید مکانیسم نوینی را شناسایی میکند که با جلوگیری از مرگ سلول یا آپوپتوز(که هنگام برخورد با نانوذرات باردار رخ میدهد) از سلولهای سرطانی تخمدان محافظت میکند. با اعمال بارهای یونی مثبت بر روی سطح سلول، نانوذرات به عنوان نابودگر سلولهای توموری عمل کرده در حالی که سلولهای سالم را به حال خود رها میکنند.
محققان کلینیک مایو، مکانیسم چگونگی کارآمدکردن نانوذرات طلا علیه سلولهای سرطان تخمدان را شناسایی کردند. نانوذرات طلای باردار مثبت، معمولا برای سلولها سمی هستند، اما سلولهای سرطانی از مسمومشدن توسط آنها، اجتناب میکنند. مطالعه جدید مکانیسم نوینی را شناسایی میکند که با جلوگیری از مرگ سلول یا آپوپتوز(که هنگام برخورد با نانوذرات باردار رخ میدهد) از سلولهای سرطانی تخمدان محافظت میکند. با اعمال بارهای یونی مثبت بر روی سطح سلول، نانوذرات به عنوان نابودگر سلولهای توموری عمل کرده در حالی که سلولهای سالم را به حال خود رها میکنند.  محققان انگلیسی آزمایش ژنتیک منحصر به فردی را توسعه دادهاند که جهش ژنتیکی و احتمال توسعه بیماری در بین سایر اعضای خانواده بیمار سرطانی را مشخص می کند. افرادی که در بستگان درجه یک خود سابقه ابتلا به بیماری سرطان دارند، احتمالا داری ژن سرکش این بیماری هستند که خطر ابتلای آنها به این بیماری مهلک را بشدت افزایش می دهد. محققان موسسه تحقیقات سرطان انگلیس با همکاری شرکت تحقیقات ژنتیک Illumina آمریکا آزمایش ژنتیک جدیدی را توسعه داده اند که به تشخیص افراد در معرض خطر ابتلا به سرطان وراثتی ناشی از ناقل بودن ژن جهش یافته کمک می کند.
محققان انگلیسی آزمایش ژنتیک منحصر به فردی را توسعه دادهاند که جهش ژنتیکی و احتمال توسعه بیماری در بین سایر اعضای خانواده بیمار سرطانی را مشخص می کند. افرادی که در بستگان درجه یک خود سابقه ابتلا به بیماری سرطان دارند، احتمالا داری ژن سرکش این بیماری هستند که خطر ابتلای آنها به این بیماری مهلک را بشدت افزایش می دهد. محققان موسسه تحقیقات سرطان انگلیس با همکاری شرکت تحقیقات ژنتیک Illumina آمریکا آزمایش ژنتیک جدیدی را توسعه داده اند که به تشخیص افراد در معرض خطر ابتلا به سرطان وراثتی ناشی از ناقل بودن ژن جهش یافته کمک می کند.  در دستاورد جالبی که میتواند بزودی رایانهها را جایگزین انسان در امور پزشکی کند، محققان بیمارستان پزشکی دانشگاه ماستریخت، فرمولهای ریاضی طراحی کردهاند که بهتر از انسان، واکنش بیماران سرطانی به شیمیدرمانی را تشخیص میدهند. هر مدل ریاضیاتی با جزئیات پزشکی شخصی و تاریخچه درمان هر بیمار تغذیه میشود و تا کنون یک مدل رایانهای از سرطان ریه توانسته بهتر از پزشکان انسان علائم آینده بیمار را پس از رادیودرمانی یا شیمیدرمانی پیشبینی کند. سازندگان این فرمولها معتقدند که بهتر است از این مدلها در عملکرد بالینی برای تصمیمگیریهای بهتر استفاده شود. محققان از مدلهای رایانهای برای تعیین میزان زنده ماندن یک گروه 21 نفری از بیماران سرطان ریه، تعداد افرادی که با مشکل تنفس روبرو میشوند و تعداد افراد دارای مشکل بلع در طول دو سال، استفاده کردند. هرچه اطلاعات بیشتری در مورد بیماران مانند ساختار ژنتیکی آنها جمعآوری میشد، مدلهای رایانهای از اهمیت بیشتری در تصمیمگیری در چگونگی واکنش به بیماریهای خاص برخوردار میشدند. دانشمندان اخیرا دریافتهاند که تومورهای سرطانی میان بیماران متفاوت بوده و درمانهای مختلف طبق ژنتیک بیماران مورد نیاز است. مدلهای رایانهای میتواند در محاسبه این بررسی پیچیده ریاضیاتی موثر باشد.
در دستاورد جالبی که میتواند بزودی رایانهها را جایگزین انسان در امور پزشکی کند، محققان بیمارستان پزشکی دانشگاه ماستریخت، فرمولهای ریاضی طراحی کردهاند که بهتر از انسان، واکنش بیماران سرطانی به شیمیدرمانی را تشخیص میدهند. هر مدل ریاضیاتی با جزئیات پزشکی شخصی و تاریخچه درمان هر بیمار تغذیه میشود و تا کنون یک مدل رایانهای از سرطان ریه توانسته بهتر از پزشکان انسان علائم آینده بیمار را پس از رادیودرمانی یا شیمیدرمانی پیشبینی کند. سازندگان این فرمولها معتقدند که بهتر است از این مدلها در عملکرد بالینی برای تصمیمگیریهای بهتر استفاده شود. محققان از مدلهای رایانهای برای تعیین میزان زنده ماندن یک گروه 21 نفری از بیماران سرطان ریه، تعداد افرادی که با مشکل تنفس روبرو میشوند و تعداد افراد دارای مشکل بلع در طول دو سال، استفاده کردند. هرچه اطلاعات بیشتری در مورد بیماران مانند ساختار ژنتیکی آنها جمعآوری میشد، مدلهای رایانهای از اهمیت بیشتری در تصمیمگیری در چگونگی واکنش به بیماریهای خاص برخوردار میشدند. دانشمندان اخیرا دریافتهاند که تومورهای سرطانی میان بیماران متفاوت بوده و درمانهای مختلف طبق ژنتیک بیماران مورد نیاز است. مدلهای رایانهای میتواند در محاسبه این بررسی پیچیده ریاضیاتی موثر باشد. پروژه شبکه تحقیقات اطلس ژنوم سرطانی با طراحی الگوریتم اختصاصی، امکان آنالیز ژنوم انسانی برای جهش های سرطانی را فراهم کرده است. نکات مبهم فراوانی درخصوص نحوه شکل گیری و رشد سلول های سرطانی وجود دارد و ژنوم انسانی این پیچیدگیها را چند برابر میکنند. با استفاده از الگوریتم اختصاصی ++Dendrix که برای آنالیز ژنوم انسانی دخیل در جهشهای سرطانی طراحی شده است، محققان قادر به شناسایی مشخصات ژنتیکی نوعی از سرطان خون موسوم به لوسمی میلوئیدی حاد شدهاند. این الگوریتم اختصاصی با کمک رایانه، اطلاعات ژنتیکی یا ژنهای موجود در سلولهای سرطانی را با ژنومهای سلولهای سالم بیمار مقایسه می کند.
پروژه شبکه تحقیقات اطلس ژنوم سرطانی با طراحی الگوریتم اختصاصی، امکان آنالیز ژنوم انسانی برای جهش های سرطانی را فراهم کرده است. نکات مبهم فراوانی درخصوص نحوه شکل گیری و رشد سلول های سرطانی وجود دارد و ژنوم انسانی این پیچیدگیها را چند برابر میکنند. با استفاده از الگوریتم اختصاصی ++Dendrix که برای آنالیز ژنوم انسانی دخیل در جهشهای سرطانی طراحی شده است، محققان قادر به شناسایی مشخصات ژنتیکی نوعی از سرطان خون موسوم به لوسمی میلوئیدی حاد شدهاند. این الگوریتم اختصاصی با کمک رایانه، اطلاعات ژنتیکی یا ژنهای موجود در سلولهای سرطانی را با ژنومهای سلولهای سالم بیمار مقایسه می کند. اخیرا روشی برای رهاسازی DNA و RNA درون یک سلول سرطانی ارائه شده است. در این روش از مولکولهای چربی در مقیاس نانو استفاده میشود. پزشکی مدرن بدنبال این است که از داروهای کوچک استفاده کند؛ داروهایی که حاوی مسکنهایی نظیر آسپرین و آنتیبیوتیکهایی نظیر پنیسیلین هستند. این داروها طول عمر بشر را افزایش میدهند. اخیرا محققان روشی یافتهاند که با استفاده از آن میتوان رهاسازی دارو را در مقیاس نانو انجام داد که این روش کارایی بیشتری نسبت به روشهای پیشین دارد. با رهاسازی DNA و RNA درون یک سلول خاص، میتوان به صورت خاص یک ژن را روشن یا خاموش کرد. از سوی دیگر یک سیستم نانومقیاس درون بدن قرار میگیرد که میتواند امکان ردیابی دارو را در بافتهای خاصی فراهم کند، همچنین این سیستم میتواند در یک دوره زمانی تعریف شده رهاسازی را انجام دهد.
اخیرا روشی برای رهاسازی DNA و RNA درون یک سلول سرطانی ارائه شده است. در این روش از مولکولهای چربی در مقیاس نانو استفاده میشود. پزشکی مدرن بدنبال این است که از داروهای کوچک استفاده کند؛ داروهایی که حاوی مسکنهایی نظیر آسپرین و آنتیبیوتیکهایی نظیر پنیسیلین هستند. این داروها طول عمر بشر را افزایش میدهند. اخیرا محققان روشی یافتهاند که با استفاده از آن میتوان رهاسازی دارو را در مقیاس نانو انجام داد که این روش کارایی بیشتری نسبت به روشهای پیشین دارد. با رهاسازی DNA و RNA درون یک سلول خاص، میتوان به صورت خاص یک ژن را روشن یا خاموش کرد. از سوی دیگر یک سیستم نانومقیاس درون بدن قرار میگیرد که میتواند امکان ردیابی دارو را در بافتهای خاصی فراهم کند، همچنین این سیستم میتواند در یک دوره زمانی تعریف شده رهاسازی را انجام دهد. تحقیقات صورت گرفته توسط محققان دانشگاه هاروارد نشان می دهد، افرادی که در خواب خروپف کرده و بیش از 9 ساعت می خوابند، دو برابر بیش از سایرین در معرض ابتلا به سرطان روده قرار دارند. این مطالعه رابطه معناداری بین مدت زمان خواب و احتمال ابتلا به سرطان روده بزرگ را بویژه در بین افرادی که دچار اضافه وزن هستند یا در هنگام خواب خروپف می کنند، نشان میدهد. افراد دچار آپنه انسدادی خواب بدلیل مختل شدن خواب ناشی از قطع تنفس، بیشتر خسته شده و تمایل به خواب طولانی تری دارند. نتایج بدست آمده در این تحقیق نشان می دهد، آپنه انسدادی خواب یا خروپف همراه با قطع تنفس نقش موثری در افزایش خطر ابتلا به سرطان ایفا می کند.
تحقیقات صورت گرفته توسط محققان دانشگاه هاروارد نشان می دهد، افرادی که در خواب خروپف کرده و بیش از 9 ساعت می خوابند، دو برابر بیش از سایرین در معرض ابتلا به سرطان روده قرار دارند. این مطالعه رابطه معناداری بین مدت زمان خواب و احتمال ابتلا به سرطان روده بزرگ را بویژه در بین افرادی که دچار اضافه وزن هستند یا در هنگام خواب خروپف می کنند، نشان میدهد. افراد دچار آپنه انسدادی خواب بدلیل مختل شدن خواب ناشی از قطع تنفس، بیشتر خسته شده و تمایل به خواب طولانی تری دارند. نتایج بدست آمده در این تحقیق نشان می دهد، آپنه انسدادی خواب یا خروپف همراه با قطع تنفس نقش موثری در افزایش خطر ابتلا به سرطان ایفا می کند. محققان دانشگاه لاند سوئد طی پژوهشی دریافتند که نوشیدن قهوه در بیماران مبتلا به سرطان سینه که داروی "تاموکسیفن" را مصرف میکنند، میتواند خطر بازگشت این سرطان را کاهش دهد. بیمارانی که طی دوره بیماری خود قرص "تاموکسیفن" را به همراه دو فنجان یا بیشتر قهوه مصرف میکنند در مقایسه با همتایان خود که یک فنجان یا اصلا قهوه نمینوشیدند، بیش از نیم درصد احتمال کمتری برای عود بیماریشان گزارش شده است.
محققان دانشگاه لاند سوئد طی پژوهشی دریافتند که نوشیدن قهوه در بیماران مبتلا به سرطان سینه که داروی "تاموکسیفن" را مصرف میکنند، میتواند خطر بازگشت این سرطان را کاهش دهد. بیمارانی که طی دوره بیماری خود قرص "تاموکسیفن" را به همراه دو فنجان یا بیشتر قهوه مصرف میکنند در مقایسه با همتایان خود که یک فنجان یا اصلا قهوه نمینوشیدند، بیش از نیم درصد احتمال کمتری برای عود بیماریشان گزارش شده است. براساس تحقیقات جدید پژوهشگران، کسانی که یک بار به سرطان عمومی پوست مبتلا شدند، بیشتر از سایر افراد در معرض ابتلا به انواع دیگر سرطانها قرار دارند. خطر ابتلا به سرطانهای دیگر در زنانی که یک بار به سرطان پوست مبتلا شدند تا 26 درصد و در مردان تا 15 درصد افزایش مییابد. پژوهشگران با انجام مطالعات بر روی 150 هزار نفر طی 20 سال به نتایج این تحقیقات دست یافتند و شاهد افزایش خطر ابتلا به سرطان در مبتلایان به سرطان پوست بودند. به گفته محققان، اگرچه کسانی که سرطان پوست داشتند بیش از دیگران در معرض ابتلا به سرطانهای دیگر هستند، اما علت اصلی ابتلا به سرطان در این افراد سرطان پوست نیست. پژوهشگران احتمال میدهند تغییراتی که در سلولها طی فرایند احیای سلولهای DNA رخ میدهد، عامل ابتلا به سرطانهای دیگر باشد.
براساس تحقیقات جدید پژوهشگران، کسانی که یک بار به سرطان عمومی پوست مبتلا شدند، بیشتر از سایر افراد در معرض ابتلا به انواع دیگر سرطانها قرار دارند. خطر ابتلا به سرطانهای دیگر در زنانی که یک بار به سرطان پوست مبتلا شدند تا 26 درصد و در مردان تا 15 درصد افزایش مییابد. پژوهشگران با انجام مطالعات بر روی 150 هزار نفر طی 20 سال به نتایج این تحقیقات دست یافتند و شاهد افزایش خطر ابتلا به سرطان در مبتلایان به سرطان پوست بودند. به گفته محققان، اگرچه کسانی که سرطان پوست داشتند بیش از دیگران در معرض ابتلا به سرطانهای دیگر هستند، اما علت اصلی ابتلا به سرطان در این افراد سرطان پوست نیست. پژوهشگران احتمال میدهند تغییراتی که در سلولها طی فرایند احیای سلولهای DNA رخ میدهد، عامل ابتلا به سرطانهای دیگر باشد. حاملین نانومقیاس حاوی برخی پروتئینها و اسیدهای نوکلئیک میتوانند برای تشخیص، رصد و درمان سرطان مغز مورد استفاده قرار گیرند. اخیرا مقالهای توسط یک تیم تحقیقاتی از دانشگاه کالیفرنیا و بیمارستان عمومی ماساچوست در نشریه «Neurosurgery» به چاپ رسیده که در آن آخرین پیشرفتهای انجام شده در بخش تومور مغز مورد بحث قرار گرفته است. در این مقاله با عنوان "the biological processes mediated by these EVs and their applications as biomarkers for brain tumor diagnosis, monitoring, and therapeutic development" ، محققان به ارائه فرصتهای موجود در استفاده از حاملین نانومقیاس برای رهاسازی دارو پرداختهاند. نویسندگان این مقاله از واژه حاملین خارج سلولی استفاده کردند که این عبارت به اجزای سلولی کپسوله شده در میان یک غشاء گفته میشود. حاملین خارج سلولی را میتوان از تمام سیالهای موجود در بدن نظیر خون و مایع نخاعی بیماران دارای تومور مغزی استخراج کرد. حاملین خارج سلولی شبیه حبابهای نانومقیاس هستند که توسط سلولهای بدن ارسال میشوند؛ این حاملین حاوی پروتئین و دیگر مواد سلولی نظیر اسیدهای نوکلئیک هستند.
حاملین نانومقیاس حاوی برخی پروتئینها و اسیدهای نوکلئیک میتوانند برای تشخیص، رصد و درمان سرطان مغز مورد استفاده قرار گیرند. اخیرا مقالهای توسط یک تیم تحقیقاتی از دانشگاه کالیفرنیا و بیمارستان عمومی ماساچوست در نشریه «Neurosurgery» به چاپ رسیده که در آن آخرین پیشرفتهای انجام شده در بخش تومور مغز مورد بحث قرار گرفته است. در این مقاله با عنوان "the biological processes mediated by these EVs and their applications as biomarkers for brain tumor diagnosis, monitoring, and therapeutic development" ، محققان به ارائه فرصتهای موجود در استفاده از حاملین نانومقیاس برای رهاسازی دارو پرداختهاند. نویسندگان این مقاله از واژه حاملین خارج سلولی استفاده کردند که این عبارت به اجزای سلولی کپسوله شده در میان یک غشاء گفته میشود. حاملین خارج سلولی را میتوان از تمام سیالهای موجود در بدن نظیر خون و مایع نخاعی بیماران دارای تومور مغزی استخراج کرد. حاملین خارج سلولی شبیه حبابهای نانومقیاس هستند که توسط سلولهای بدن ارسال میشوند؛ این حاملین حاوی پروتئین و دیگر مواد سلولی نظیر اسیدهای نوکلئیک هستند. یک تیم تحقیقات سوئیسی در بررسی ساختار بافتهای سرطان پستان با بافتهای سالم به یک تفاوت بارز میان این دو نوع بافت پی بردند: بافتهای سرطانی ترکیبی از مناطق نرم و سخت بوده در صورتی که بافتهای سالم دارای سفتی یکسانی هستند. با این کشف گام بزرگی به سوی بهبود روشهای تشخیص سرطان پستان برداشته میشود، همچنین یک ردپای نانومکانیکی منحصر بفرد مربوط به تومورهای سرطانی به دست آمده است که از آن میتوان برای تشخیص بیماری سرطان استفاده کرد. این تیم تحقیقاتی نتایج یافتههای خود را در پنجاهوهفتمین نسشت سالانه انجمن بیوفیزیک که در فلادلفیا برگزار شد، ارائه کردند.
یک تیم تحقیقات سوئیسی در بررسی ساختار بافتهای سرطان پستان با بافتهای سالم به یک تفاوت بارز میان این دو نوع بافت پی بردند: بافتهای سرطانی ترکیبی از مناطق نرم و سخت بوده در صورتی که بافتهای سالم دارای سفتی یکسانی هستند. با این کشف گام بزرگی به سوی بهبود روشهای تشخیص سرطان پستان برداشته میشود، همچنین یک ردپای نانومکانیکی منحصر بفرد مربوط به تومورهای سرطانی به دست آمده است که از آن میتوان برای تشخیص بیماری سرطان استفاده کرد. این تیم تحقیقاتی نتایج یافتههای خود را در پنجاهوهفتمین نسشت سالانه انجمن بیوفیزیک که در فلادلفیا برگزار شد، ارائه کردند. محققان مرکز تحقیقات سرطان انگلستان در دانشگاه کمبریج و همچنین دانشمندان هلندی خبر از کشف نوع جدیدی از سرطان روده داده اند که پیامدهای بدتری را در مقایسه با سایر سرطان های روده بزرگ دارد و در مقابل درمان های خاص، مقاومت نشان می دهد. محققان با بررسی بر اطلاعات 146 ژن مرتبط با سرطان روده که از 11 هزار بیمار به دست آمده بود متوجه شدند که بیش از یک چهارم افراد مبتلا به نوع جدیدی از سرطان روده شده اند که پیش از این در زیر مجموعه هیچ کدام از سرطان ها دیده نشده بود. برای این دسته از بیماران مبتلا به نوع جدید سرطان روده، احتمال بدتر شدن، تهاجمی تر شدن تومورها و همچنین مقاومت به داروهایی درمانی نظیر "ستوکسیمب"، زیاد گزارش شده بود.
محققان مرکز تحقیقات سرطان انگلستان در دانشگاه کمبریج و همچنین دانشمندان هلندی خبر از کشف نوع جدیدی از سرطان روده داده اند که پیامدهای بدتری را در مقایسه با سایر سرطان های روده بزرگ دارد و در مقابل درمان های خاص، مقاومت نشان می دهد. محققان با بررسی بر اطلاعات 146 ژن مرتبط با سرطان روده که از 11 هزار بیمار به دست آمده بود متوجه شدند که بیش از یک چهارم افراد مبتلا به نوع جدیدی از سرطان روده شده اند که پیش از این در زیر مجموعه هیچ کدام از سرطان ها دیده نشده بود. برای این دسته از بیماران مبتلا به نوع جدید سرطان روده، احتمال بدتر شدن، تهاجمی تر شدن تومورها و همچنین مقاومت به داروهایی درمانی نظیر "ستوکسیمب"، زیاد گزارش شده بود. محققان آلمانی میگویند مبتلایان به سرطان سینه که تومورهای آنان به ریه گسترش یافته است در صورتی میتوانند عمر بیشتری را تجربه کنند که تومورهای ریه را بیرون بیاورند. میانگین بقای مبتلایان به سرطان سینه که بیماریشان به سایر قسمتهای بدن توسعه پیدا کرده و تحت رژیمهای شیمی درمانی قرار دارند، بین 12 الی 24 ماه است. گمانها بر این است که انجام عمل جراحی برای این دست بیماران موثر نیست. با این وجود محققان آلمانی "دانشگاه لودویگ ماکسیمیلیان" و "هایدلبرگ" با انجام آزمایشی بر 81 بیمار دریافتند که در صورت خارج کردن تمام تومورهای ریه، شانس بقا به 103 ماه افزایش مییابد. به گفته دکتر"هانز هافمن" نتایج به دست آمده اهمیت انجام این گونه عمل جراحی را در رویکردهای چند جانبه برای درمان این بیماران نشان میدهد. این پژوهش در مجله "The Annals of Thoracic Surgery" منتشر شده است.
محققان آلمانی میگویند مبتلایان به سرطان سینه که تومورهای آنان به ریه گسترش یافته است در صورتی میتوانند عمر بیشتری را تجربه کنند که تومورهای ریه را بیرون بیاورند. میانگین بقای مبتلایان به سرطان سینه که بیماریشان به سایر قسمتهای بدن توسعه پیدا کرده و تحت رژیمهای شیمی درمانی قرار دارند، بین 12 الی 24 ماه است. گمانها بر این است که انجام عمل جراحی برای این دست بیماران موثر نیست. با این وجود محققان آلمانی "دانشگاه لودویگ ماکسیمیلیان" و "هایدلبرگ" با انجام آزمایشی بر 81 بیمار دریافتند که در صورت خارج کردن تمام تومورهای ریه، شانس بقا به 103 ماه افزایش مییابد. به گفته دکتر"هانز هافمن" نتایج به دست آمده اهمیت انجام این گونه عمل جراحی را در رویکردهای چند جانبه برای درمان این بیماران نشان میدهد. این پژوهش در مجله "The Annals of Thoracic Surgery" منتشر شده است. دانشمندان دانشگاه میسوری روش جدیدی را برای درمان سرطان معرفی کردهاند که بدون داشتن عوارض جانبی این بیماری مهلک را درمان میکند. مدتی کوتاه پس از کشف نوترون در سال 1932، تعدادی از دانشمندان به پتانسیل «درمان گیراندازی نوترون بور» (BNCT) به عنوان درمانی برای سرطان پی بردند. با این حال علیرغم دههها تحقیق، مشکل یافتن یک عامل تحویل که بتواند تومورها را بدون آسیبرساندن به بافتهای اطراف به طور کارآمدی هدف قرار دهد، به قوه خود باقی ماند.
دانشمندان دانشگاه میسوری روش جدیدی را برای درمان سرطان معرفی کردهاند که بدون داشتن عوارض جانبی این بیماری مهلک را درمان میکند. مدتی کوتاه پس از کشف نوترون در سال 1932، تعدادی از دانشمندان به پتانسیل «درمان گیراندازی نوترون بور» (BNCT) به عنوان درمانی برای سرطان پی بردند. با این حال علیرغم دههها تحقیق، مشکل یافتن یک عامل تحویل که بتواند تومورها را بدون آسیبرساندن به بافتهای اطراف به طور کارآمدی هدف قرار دهد، به قوه خود باقی ماند. نتایج پژوهشی جدید نشان میدهد که اثرات ضد التهابی آسپرین میتواند خطر بروز ملانوم (بدخیمترین سرطان پوست) را در زنان کاهش دهد.
نتایج پژوهشی جدید نشان میدهد که اثرات ضد التهابی آسپرین میتواند خطر بروز ملانوم (بدخیمترین سرطان پوست) را در زنان کاهش دهد.  دانشمندان در تلاش برای استفاده از نانوذرات پلاسمونیکی در درمان سرطان هستند که به موجب آن انرژی نور به منظور کشتن سلولهای سرطانی به گرما تبدیل میشود.
دانشمندان در تلاش برای استفاده از نانوذرات پلاسمونیکی در درمان سرطان هستند که به موجب آن انرژی نور به منظور کشتن سلولهای سرطانی به گرما تبدیل میشود.  دانشمندان موفق به توسعه تست تنفسی با قابلیت تشخیص 90 درصدی نشانههای شیمیایی سرطان معده شدند.
دانشمندان موفق به توسعه تست تنفسی با قابلیت تشخیص 90 درصدی نشانههای شیمیایی سرطان معده شدند. مصرف امگا 3 در جلوگیری از سرطان پوست موثر است.
مصرف امگا 3 در جلوگیری از سرطان پوست موثر است.  مصرف منظم ماهیهای روغنی که غنی از اسیدهای چرب امگا 3 هستند میتواند تا 30 درصد پیشرفت سرطان سینه را کاهش دهد.
مصرف منظم ماهیهای روغنی که غنی از اسیدهای چرب امگا 3 هستند میتواند تا 30 درصد پیشرفت سرطان سینه را کاهش دهد. دانشمندان دانشگاه میسوری ثابت کردهاند درمانی که برای سرطان پروستات از نانوذرات طلای رادیواکتیو استفاده میکند، برای استفاده در سگها بیخطر است.
دانشمندان دانشگاه میسوری ثابت کردهاند درمانی که برای سرطان پروستات از نانوذرات طلای رادیواکتیو استفاده میکند، برای استفاده در سگها بیخطر است. بر اساس نتایج پژوهشی جدید، داروی مورد استفاده در درمان سرطان، میتواند روند پیشرفت بیماری خود ایمن مالتیپل اسکلروزیس (ام اس) را نیز کاهش دهد.
بر اساس نتایج پژوهشی جدید، داروی مورد استفاده در درمان سرطان، میتواند روند پیشرفت بیماری خود ایمن مالتیپل اسکلروزیس (ام اس) را نیز کاهش دهد.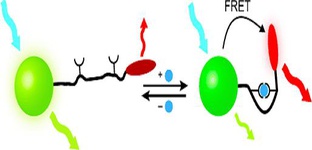 پژوهشگران
پژوهشگران پژوهشگران موسسه فناوری سلطنتی ملبورن، نانوذراتی تولید کردهاند که بسیار ارزان و غیرسمی بوده و از آن میتوان برای رادیودرمانی سرطان استفاده کرد.
پژوهشگران موسسه فناوری سلطنتی ملبورن، نانوذراتی تولید کردهاند که بسیار ارزان و غیرسمی بوده و از آن میتوان برای رادیودرمانی سرطان استفاده کرد. محققان دانشگاه رایس روشی ارائه کردهاند که با استفاده از آن میتوان برخی سلولهای بیمار را از بین برد و برخی دیگر را درمان کرد.
محققان دانشگاه رایس روشی ارائه کردهاند که با استفاده از آن میتوان برخی سلولهای بیمار را از بین برد و برخی دیگر را درمان کرد.  قارچ «
قارچ « مصرف بیش از حد قند و وقوع دیابت میتواند باعث افزایش بروز سرطان در افراد شود.
مصرف بیش از حد قند و وقوع دیابت میتواند باعث افزایش بروز سرطان در افراد شود.  مصرف سبزیجات چلیپایی به بهبود سرطان سینه کمک میکنند.
مصرف سبزیجات چلیپایی به بهبود سرطان سینه کمک میکنند.  دانشمندان دانشگاه بلونیا در ایتالیا برای نخستین بار موفق به ساخت نوعی ویروس تبخال شدهاند که میتواند از انتشار سرطان پستان و رحم جلوگیری کند.
دانشمندان دانشگاه بلونیا در ایتالیا برای نخستین بار موفق به ساخت نوعی ویروس تبخال شدهاند که میتواند از انتشار سرطان پستان و رحم جلوگیری کند.  سطوح بالای کلسیم خون میتواند نشانهای برای وقوع سرطان تخمدان باشد
سطوح بالای کلسیم خون میتواند نشانهای برای وقوع سرطان تخمدان باشد